Alternativmethoden – in-vitro Verfahren
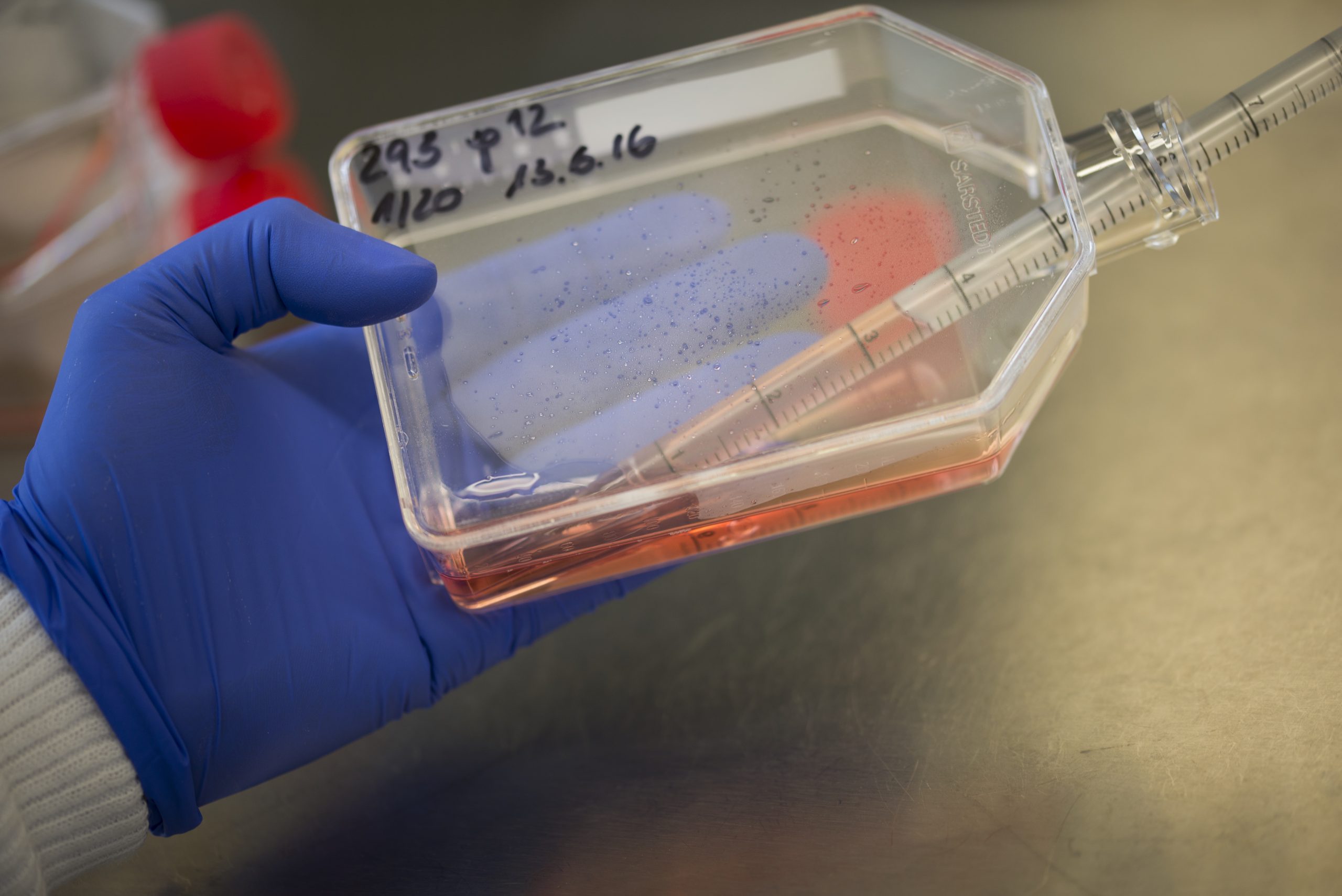
In vitro bedeutet übersetzt „im Reagenzglas“. Bei den in vitro Verfahren kultivieren Wissenschaftler*innen über längere Zeit lebende Zellen oder Gewebe in der Petrischale oder frieren die Zellen und Gewebe in flüssigem Stickstoff ein (Kryokonservierung bei -196°C). Wichtige Bedeutung haben in vitro Verfahren beispielsweise bei der Erfüllung von Kinderwünschen (die sogenannte artifzielle Reproduktionsmedizin), sowie zur Arterhaltung und Zucht von Tieren. Ebenfalls zu den in vitro Verfahren gehört das Züchten von organähnlichen Strukturen (Organoiden), die durch das Zusammenführen weniger verschiedener Zelltypen (Muskelzelle, Nervenzelle, Endothelzelle etc.) in der Petrischale gebildet werden. Oft verwenden Wissenschaftler*innen dazu menschliche oder tierische so genannte „induzierte pluripotente Stammzellen“. Pluripotente Stammzellen, die vor allem in Embryonen vorkommen, können sich noch zu verschiedenen Körperzellen entwickeln. Heutzutage ist es in bestimmten Fällen möglich, Zellen, die sich im erwachsenen Organismus schon zu einem bestimmten Typ entwickelt hatten, wieder in diesen pluripotenten Status zurück zu versetzen. Daher der Begriff „induziert“ (mehr Informationen dazu finden Sie in unserem Video „Was sind Organoide“). Erhalten diese Stammzellen anschließend bestimmte Signale, können Forschende steuern, in was für einen Typ Zelle sich diese entwickeln. Auf diese Weise können sie gezielt Organoide herstellen.
Methode
Zellkulturen verwenden Wissenschaftler*innen in der Forschung häufig, um grundlegende Eigenschaften von Zellen und Zellverbänden zu verstehen. Primäre Zellkulturen, die unmittelbar aus dem lebenden Organismus stammen, sind jedoch häufig kurzlebig und die Zellen sterben nach einer gewissen Zeit ab. Um Zellen dauerhaft in Kultur halten zu können, benutzt man permanente Zellkulturen (sogenannte immortalisierte Zellen). In der Regel werden dafür einzelne Zelllinien getrennt und aus ihrem natürlichen Zellverband gelöst. Diese Zellen teilen sich ähnlich einer Krebszelle immer weiter und sind so praktisch unbegrenzt lebensfähig. Dadurch wird eine primäre Zellkultur zu einer permanenten Zellkultur, die wiederholt vermehrt und in flüssigem Stickstoff eingefroren (kryokonserviert) werden kann.
Anwendungsbeispiele
In permanenten Zellkulturen können Forschende die Eigenschaften von spezifischen Zelltypen in einer kontrollierten Umgebung wiederholt untersuchen. Oft ziehen sie die Zellkultur auch heran, um neue Wirkstoffe, sei es für Arzneimittel oder für neue Forschungsmethoden, auf ihre grundlegende Funktion und Wirksamkeit hin zu testen. Dadurch lassen sich schädliche Wirkstoffe und fehlerhafte Forschungsmethoden aussortieren, bevor sie am Tier getestet werden.
Chancen und Grenzen
Permanente Zellkulturen ermöglichen eine Untersuchung ohne Versuchstiere über sehr lange Zeit. Allerdings ändern diese Zellen, wenn sie sich beliebig oft teilen (Immortalisierung), häufig ihre ursprünglichen Eigenschaften. Sie bilden somit nur noch begrenzt die Verhältnisse aus dem ehemaligen Organ ab. Experimente in permanenter Zellkultur sind daher oftmals nicht als vollständiger Ersatz für Tierversuche zu verstehen. Sie gelten dann vielmehr als Ergänzung oder Vorversuch. Mit Hilfe der Zellkultur können Wissenschaftler*innen vor dem Tierversuch wichtige Ergebnisse sammeln. Diese Erkenntnisse machen einige Tierversuche unnötig oder helfen dabei, die Zahlen von Versuchstieren zu reduzieren.
Co-Kulturen von Zellen
Unterschiedliche Zellen (Muskel, Nerven, Knochen, Haut, Darm, Immunsystem etc.) interagieren miteinander und tauschen Informationen aus. Für ihre normale biologische Funktion benötigen Zellen in den meisten Fällen Signale von benachbarten oder auch entfernt liegenden Zellen eines anderen Typs. Um dieses Zusammenspiel zwischen Zellen zu untersuchen, können Forschende verschiedene Zellen gemeinsam kultivieren (sogenannte Co-Kulturen).
Methode
Organoide sind aus pluripotenten Stammzellen gezüchtete Gewebe, die bestimmte Teilfunktionen voll entwickelter Organe wie Leber, Herz, Nieren oder Gehirn simulieren und so eine Mini-Organversion nachbilden. Die Stammzellen können sich, abhängig von den zur Verfügung stehenden Nährstoffen und Signalen aus dem Nährmedium, zu ausgewählten Organoiden in vitro zusammenfügen lassen. Diese Organoide reagieren in Experimenten ähnlich dem Organ im menschlichen Körper und ermöglichen so Einblicke in die Organfunktionen bei Krankheiten oder bei der Zugabe von Erregern oder Wirkstoffen.
Anwendungsbeispiele
Hirnorganoide zum Beispiel bilden Schichten von Nervenzellen (Neuronen), die Teilen des menschlichen oder tierischen Gehirns ähneln. Dadurch können grundlegende Aspekte des Gehirns, zum Beispiel von neurodegenerativen Erkrankungen wie Alzheimer, untersucht werden. Ein anderes Beispiel sind Hautorganoide. Sie bilden die Schichten der menschlichen Haut als kleines in vitro erzeugtes Gewebestück nach. Diese können zum Beispiel genutzt werden, um die Giftigkeit und Ätzwirkung von Wirkstoffen für die Haut zu testen, ohne dafür Tiere heranziehen zu müssen.
Auch in der Covid-19 Pandemie spielen Organoide eine Rolle.. Dr. Thorsten Müller forscht an der Ruhr-Universität Bochum am Lehrstuhl für Biochemie an der Entwicklung von Organoid-Modellen für die Lunge. Er und Prof. Dr. Stephanie Pfänder untersuchen nun, wie sich das SARS-CoV-2 Virus in den Lungenzellen nach der Infektion vermehrt und welche Wirkstoffe die Vermehrung hemmen können. Dafür wird das Lungenorganoid in einem für gefährliche Viren ausgelegten S3-Labor mit dem Corona-Virus infiziert und anschließend ein potenzieller Wirkstoff dazugegeben. Durch spezielle Analysen wie der sogenannten quantitativen PCR kann die Virusmenge anschließend gemessen werden. Langfristig können aus dieser Forschung Medikamente hervorgehen, die bei einer Infektion den Verlauf von Covid-19 abmildern.
Chancen und Grenzen
Obwohl sie ihnen ähneln, sind Organoide nicht vergleichbar mit der Komplexität voll ausgereifter Organe; siehaben auch nur eine begrenzte Lebensdauer. Kognitive Fähigkeiten wie Lernen und Gedächtnis können daher zum Beispiel noch nicht an Hirnorganoiden untersucht werden. Genauso kann der Verlauf einer Virusinfektion an den Lungenorganoiden noch nicht nachvollzogen werden – den Organoiden fehlt das Immunsystem. „Zu Beginn der Entwicklung eines Menschen gibt es 3 Gewebevorstufen. Das Endoderm, das Mesoderm und das Ektoderm. Die Lunge entwickelt sich aus dem Endoderm, daher werden auch die Lungenorganoide aus diesem Gewebe differenziert. Die Zellen des Immunsystems entstehen aber aus dem Mesoderm, sind also nicht im Organoid enthalten“, so Müller. Langfristig ist es aber das Ziel, einen Weg zu finden, diese beiden Gewebearten zu kombinieren, um den Lungenorganoiden ein Immunsystem zu geben.
In der Krebsforschung gewinnen Organoide zunehmend an Bedeutung. Die Forschenden verwenden Zellen verschiedener Krebspatient*innen, um Organoide zu züchten, die Tumore entwickeln. Anhand dieser können sie deren Wachstum sehr genau untersuchen. Ziel ist es, auf diese Weise Therapien zu entwickeln, die auf einzelne Patient*innen zugeschnitten sind. Allerdings sind Organoide auch hier noch eingeschränkt, was die Funktionalität und Stabilität von Geweben betrifft. Um diese zu verbessern, müssten Forschende andere Zellsysteme, wie zum Beispiel das Blutgefäßsystem, in die Organoide einbinden. Wissenschaftler*innen forschen aktuell daran, diese Versorgung mit Blutgefäßen oder die Neubildung von Blutgefäßen (Vaskularisierung) bei Organoiden zu ermöglichen.
Sie sehen gerade einen Platzhalterinhalt von Standard. Um auf den eigentlichen Inhalt zuzugreifen, klicken Sie auf den Button unten. Bitte beachten Sie, dass dabei Daten an Drittanbieter weitergegeben werden.
Weitere InformationenMethode
Der Multi-Organchip gilt als eine der großen Hoffnungen der Medizintechnik. Es handelt sich hierbei um ein System aus verschiedenen menschlichen Organen im Miniformat, den Organoiden. Diese sind auf einer Kunststoffplatte, die kleiner ist als ein Smartphone, untergebracht. Sie sind durch künstliche Kreisläufe miteinander verbunden. Wissenschaftler*innen können durch diesen Kreislauf die Mini-Organe versorgen. Sie können auf diese Weise zum Beispiel Wirkstoffe einbringen und die Reaktion der Mini-Organe beobachten. Das Material für diese dreidimensionalen Zell- und Gewebemodelle stammt aus Organspenden oder Gewebeentnahmen (Biopsien).
Anwendungsbeispiele
Das größte Potenzial von Organ-on-a-chip-Systemen sehen Wissenschaftler*innen in der Entwicklung von Medikamenten und in Giftigkeitstests. Sie helfen bei der Identifikation von Wirkstoffkandidaten, in vorklinischen Wirksamkeits- und Giftigkeitstests sowie während klinischer Studien. 2020 wurde ein Chip mit 6 Organoiden entwickelt (Leber, Herz, Lunge, Gefäße, Hoden, Dickdarm und Gehirn), der zukünftig für Giftigkeitsprüfungen von Arzneimitteln verwendet werden soll. An solchen Chips kann die Wirkung eines Arzneimittels sowohl am Zielorgan als auch an benachbarten Organen untersucht werden. Das Organ-on-a-chip-System kommt jedoch nicht nur in Pharmakologie zum Einsatz, sondern auch in der Grundlagenforschung und in der klinischen Forschung.
Chancen und Grenzen
Organ-on-a-chip-Systeme, so die Hoffnung, sollen jene Lücken schließen, die bei der Übertragbarkeit zwischen Tier und Mensch offen bleiben – So ließen sich einmal jene Medikamente, die zwar im Tiermodell, jedoch anschließend nicht im Menschen Wirkung zeigen, frühzeitig entdecken. Andersherum ließen sich auch Wirkstoffe entdecken, die nicht im Tier, dafür aber im Menschen Wirkung zeigen. Langfristiges Ziel ist der Body-on-a-chip. Er soll möglichst alle Organe des menschlichen Körpers oder Tieres in Organoiden nachbilden.
Trotz all der Fortschritte, die diese Technologie in den vergangenen Jahren gemacht hat, wird sie einen kompletten Verzicht auf Tierversuche erst einmal nicht ermöglichen. Dazu sind Organe mit all ihren physiologischen Eigenschaften und biochemischen Prozessen im Körper zu komplex. So suchen Wissenschaftler*innen nach Lösungen, den Blutkreislauf 1:1 nachzubilden. Auch die Abbildung des Immunsystems in seiner ganzen Komplexität stellt Forschende derzeit noch vor eine Herausforderung. Die Zellen auf Organ-on-a-Chip-Systemen haben nur eine sehr begrenzte Überlebensdauer, somit sind Langzeitstudien zu Medikamenten-Wirkungen und Zellalterung nicht möglich. Die Kernfunktionen des Organismus, wie der systemische Blutdruck oder die Funktion des Herzens sowie grundlegende Hirnfunktionen lassen sich ebenfalls noch nicht exakt darstellen. Somit kann dieses System in der Forschung Tierversuche nicht in allen Fällen ersetzen. In einigen Forschungsbereichen ist der Einsatz eines Organ-on-a-chip-Systems generell schwer vorstellbar. Die Entwicklungsbiologie kann in einem solchen Organoid-System nicht dargestellt werden. Für die epigenetischen Vererbung, also die Weitergabe von Merkmalen von einer Generation zur nächsten, müssen Ersatzmethoden zum Tierversuch ebenfalls noch entwickelt werden.
Wussten Sie es?
<!– wp:acf/flipbox {"id":"block_61152ce4b0d4d","name":"acf/flipbox","data":{"field_6113dcc823eeb":"vertikal","field_6113dcfd23eec":"#464b96","field_6113dd2023eed": „Bei der \u003cem\u003ein vitro\u003c/em\u003e Fertilisation, sowohl beim Menschen als auch bei Tieren, bringen Wissenschaftler*innen isolierte Eizellen und Spermien im Reagenzglas zur Befruchtung. Die entstehenden Embryonen können für wenige Tage \u003cem\u003ein vitro\u003c/em\u003e gehalten werden (bis zu den sogenannten Stadien Morula oder Blastula) und anschließend der austragenden Mutter eingesetzt werden\u0026lt;/font\u0026gt;.“,“field_6113dd4b23eee“:“#ffffff“,“field_6113dd6e23eef“:“Sowohl Eizellen und Spermien, als auch die genannten frühen Embryonen, lassen sich einfrieren. Diese so genannte Kryokonservierung ist eine wichtige Methode zur Erhaltung vom Aussterben bedrohter Tierarten und zum Erhalt der genetischen Vielfalt.“},“align“:“center“,“mode“:“edit“} /–>Bei der in vitro Fertilisation, sowohl beim Menschen als auch bei Tieren, bringen Wissenschaftler*innen isolierte Eizellen und Spermien im Reagenzglas zur Befruchtung. Die entstehenden Embryonen können für wenige Tage in vitro gehalten werden (bis zu den sogenannten Stadien Morula oder Blastula) und anschließend der austragenden Mutter eingesetzt werden.
Sowohl Eizellen und Spermien, als auch die genannten frühen Embryonen, lassen sich einfrieren. Diese so genannte Kryokonservierung ist eine wichtige Methode zur Erhaltung vom Aussterben bedrohter Tierarten und zum Erhalt der genetischen Vielfalt.
Der Begriff Tissue Engineering bedeutet übersetzt Gewebekonstruktion oder Gewebezüchtung. Durch die Kultivierung von Zellen, oft auch Co-Kulturen verschiedener Zellarten, wird biologisches Gewebe in vitro hergestellt. Diese soll der Transplantation in den Menschen dienen, um krankes Gewebe zu ersetzen. Zwei vielversprechende Ansätze befinden sich aktuell in der klinischen Prüfung. Zum einen und zum anderen Langerhans-Inseln zur Implantation in die Bauchspeicheldrüse von Diabetikern.
In beiden Ansätzen wird das Gewebe in vitro mit den notwendigen Zellen bestückt. Anschließend wird es bei Patient*innen transplantiert und wächst dort weiter. Durch die optimale Anpassung an die Patient*innen werden mitwachsende Herzklappen nicht abgestoßen. Bereits 2008 wurde in Deutschland zum ersten Mal eine mitwachsende Herzklappe an der medizinischen Hochschule Hannover einem Patienten implantiert.