Neben den Tierversuchen in der Grundlagen- und angewandten Forschung gibt es eine ganze Reihe von Tierversuchen, die durch Gesetze, Verordnungen oder Richtlinien auf EU- und nationaler Ebene dazu vorgesehen sind, Daten zur Sicherheit von Medikamenten für Menschen oder chemischer Substanzen zu gewinnen. Sie machen etwa ein Fünftel aller Tierversuche aus. Zu diesen Vorschriften zählen unter anderem:
- Arzneimittelgesetz
- Chemikaliengesetz
- Gentechnikgesetz
- Infektionsschutzgesetz
- Lebensmittel-, Bedarfsgegenstände- und Futtermittelgesetz
- Pflanzenschutzgesetz
- Tierseuchengesetz
- Verordnung über Medizinprodukte
- Verordnung über Detergenzien (reinigende Stoffe in Reinigungs- und Waschmitteln)
- Verordnung über Pflanzenschutzmittel und Pflanzenschutzgeräte
Auf europäischer Ebene gibt es verschiedene Richtlinien und Verordnungen, die Tierversuche im Rahmen der Stoff- und Verfahrensprüfung vorsehen. In diesen Fällen hat EU-Recht Vorrang vor nationalem Recht. Daher können Tierversuche in Sicherheitsprüfungen verpflichtend sein, obwohl sie in den nationalen Bestimmungen nicht verankert sind.
Für die Entwicklung und Zulassung von Arzneimitteln sind vorgeschriebene Tierversuche unabdingbar. Die Wirksamkeit, Verträglichkeit und Qualität neuer Medikamente werden – genauso wie die anderer Medizinprodukte – streng kontrolliert. Für die Untersuchung von möglichen Wirkstoffen in der vorklinischen Phase sind sogar Tests an mindestens zwei verschiedenen Tierarten (in der Regel ein Nagetier wie Maus oder Ratte und ein anderes Säugetier wie Hund oder Affe) erforderlich.
Viele andere vorgesehene Versuche dienen dazu, Mensch und Umwelt vor schädlichen Einflüssen einer Vielzahl von chemischen Stoffen zu schützen. Beispielhaft seien an dieser Stelle die Prüfung von chemischen Stoffen auf deren Giftigkeit (Toxizität), die Sicherheitstests von Agrochemikalien wie beispielsweise Pflanzenschutzmittel oder etwa Wasseruntersuchungen mit Fischen sowie deren Larven oder Eiern genannt.
Tierversuche für solche Zwecke werden als regulatorische Tierversuche bezeichnet und in der Regel in einem standardisierten Verfahren durchgeführt. Solche Versuche müssen in einem vereinfachten Genehmigungsverfahren bei der zuständigen Behörde beantragt werden (§8a Tierschutzgesetz). Vor der Neuerung des Tierschutzgesetzes im Juni 2021 waren gesetzlich vorgeschriebene Tierversuche nur anzeige- und nicht genehmigungspflichtig. Die vereinfachte Genehmigung, sowie früher das Anzeigeverfahren, gilt jedoch ausdrücklich nicht für Versuche, die voraussichtlich mit schweren Belastungen für die Versuchstiere verbunden sind sowie für alle Versuche mit Affen: Hier sind auch regulatorische Studien voll genehmigungspflichtig. Für alle genehmigungspflichtigen Tierversuche gibt es eine öffentlich einsehbare allgemeinverständliche Projektzusammenfassung und eine §15 Tierversuchskommission unterstützt die Behörde bei der Prüfung der Anträge.
Unabhängig davon, ob ein Tierversuch das vereinfachte oder das vollumfängliche Genehmigungsverfahren durchläuft, müssen der zuständigen Behörde gemäß Versuchstiermeldeverordnung Art, Herkunft und Zahl aller verwendeten Wirbeltiere oder Kopffüßer, sowie Zweck, Art und Schweregrad der Versuche gemeldet werden, was der statistischen Erfassung der durchgeführten Tierversuche dient – zu der Deutschland gemäß Artikel 54 der EU-Richtlinie verpflichtet ist
Nach der offiziellen Statistik des Bundesministeriums für Ernährung und Landwirtschaft (BMEL) entfielen im Jahr 2019 etwa 10 Prozent der Versuchstiere auf den Bereich der Herstellung oder die Qualitätskontrolle von medizinischen Produkten. Darüber hinaus sind annähernd 16 Prozent der Tiere in toxikologischen Sicherheitsprüfungen eingesetzt worden.
Auch für die regulatorischen Tierversuche gilt die Umsetzung des “3R-Prinzips“. Bei der weiteren Vermeidung von Tierversuchen könnte zusätzlich eine länderübergreifende Vereinheitlichung der Sicherheitsanforderungen an international gehandelte Stoffe und Produkte helfen.

In der Tat hat sowohl die EU also auch die Organisation für wirtschaftliche Zusammenarbeit und Entwicklung (OECD) Richtlinien für Stoffprüfungen aufgestellt. Sicherheitsnachweise, die diese Vorgaben erfüllen, werden in allen 34 Mitgliedsstaaten dieser internationalen Handelsorganisation anerkannt. Auch bei den Arzneimitteln gibt es Bestrebungen, die Beurteilungskriterien bei der Zulassung zu vereinheitlichen. So erarbeitet das International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH) empfehlende Richtlinien für die Bewertung der Qualität, Wirksamkeit und Unbedenklichkeit von Arzneimitteln in Europa, den USA und Japan.
So sollen verstärkt nicht mehr in jedem Land neue Tierversuche erforderlich sein, um für ein und denselben Stoff Wirksamkeits- oder Sicherheitsnachweise zu erbringen.
Außerdem bewertet die OECD neue Alternativmethoden. Werden sie von ihr akzeptiert, können sie einzelne Tierversuche ersetzen.
Für welche Qualitäts- und Sicherheitsprüfungen sind Tierversuche vorgesehen?
Das Arzneimittelrecht der EU besteht aus mehreren Richtlinien und Verordnungen und regelt die Entwicklung, Zulassung, Herstellung und Abgabe von Arzneimitteln. Das deutsche Arzneimittelgesetz thematisiert nicht nur Pharmazeutika für Menschen, sondern auch für Tiere. Ziel des Arzneimittelrechts ist es, mögliche Gefahren von Medikamenten zu benennen und abzuwehren sowie deren Qualität und Wirksamkeit sicherzustellen. Arzneimittel unterliegen daher einer Zulassungspflicht. Für die Zulassung ist es erforderlich, die Qualität, Sicherheit und Wirksamkeit des neuen Medikaments bei der Zulassungsbehörde nachzuweisen.
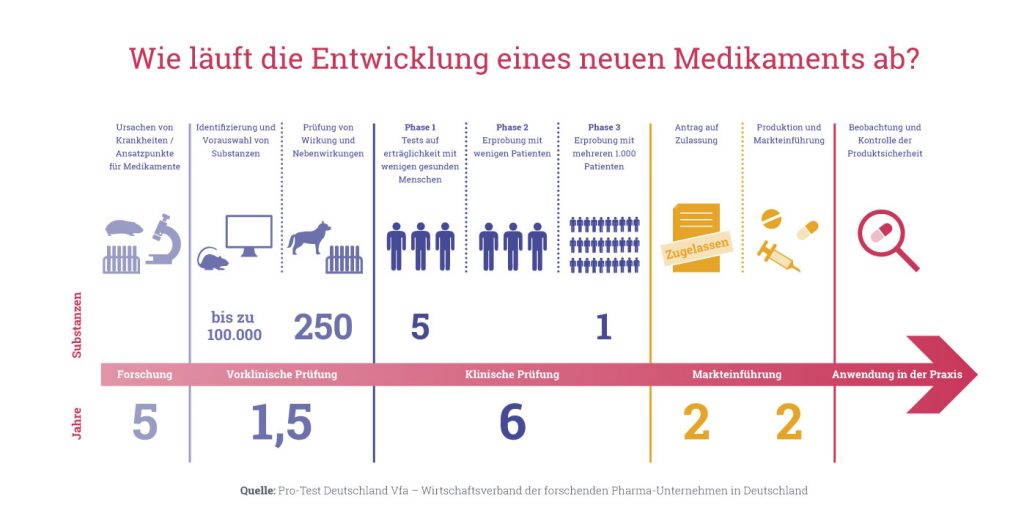
Die Entwicklung neuer Arzneistoffe beruht im Wesentlichen auf Tierversuchen (vorklinische Phase) und klinischen Studien. Für Wirksamkeits- sowie Sicherheitprüfungen sind Tierversuche zwingend vorgeschrieben, bevor ein neuer Arzneistoff an Menschen getestet werden darf.
Chemische Stoffe müssen innerhalb der EU registriert und im Hinblick auf ihre Sicherheit bewertet werden. Die 2007 in Kraft getretene Chemikalien-Verordnung REACH (Abkürzung für „Registration, Evaluation, Authorisation and Restriction of Chemicals“) legt für die EU fest, welche Stoffe das sind und wie die Registrierung, Bewertung, Zulassung und Beschränkung der Chemikalien abzulaufen haben. Die Einhaltung der Vorgaben beaufsichtigt die parallel geschaffene Europäische Agentur für chemische Stoffe (ECHA) in Helsinki. Wesentliche Teile von REACH sind in das deutsche Gesetz zum Schutz vor gefährlichen Stoffen (ChemG) übernommen worden.
Primäres Ziel von REACH ist es, den Schutz der menschlichen Gesundheit und der Umwelt vor Schäden durch chemische Verbindungen und Produkte zu verbessern. Zusätzlich bekennt sich REACH zum Vermeidungsprinzip und zur Förderung alternativer Testverfahren für Tierversuche, die für die Sicherheitsbewertungen vorgeschrieben sind. Versuche an Wirbeltieren sollen nur als letzte Möglichkeit in Betracht kommen. Alternative Verfahren kommen dann zum Einsatz, wenn sie positiv bewertet und anerkannt wurden. Darüber hinaus sieht die Verordnung eine Informationspflicht zu bereits durchgeführten Tests vor, so sollen durch eine gemeinsame Datennutzung unnötige Mehrfachversuche vermieden werden.
Vor und nach ihrem Inkrafttreten hat die Verordnung zu einigen Kontroversen geführt. Sie verpflichtet nämlich Hersteller, Importeure und Anwender, nicht nur alle neuen Erzeugnisse dem Prüfverfahren zu unterziehen, wenn die jährlich produzierte Menge größer ist als 1000 Kilogramm. Vielmehr erstreckt sich die Verpflichtung auch auf Altchemikalien, die bereits vor dem Erlass von REACH auf dem Markt waren. Daraus ergibt sich bei geschätzt 30.000 zu testenden Stoffen ein erheblicher Bedarf an Tierversuchen. Bis zum 1. Juni 2018 sollen alle Chemikalien auf dem EU-Markt schrittweise getestet und bei der ECHA registriert sein.
Biozide sind Chemikalien, die im nicht-landwirtschaftlichen Bereich zur Schädlingsbekämpfung eingesetzt werden. Sie sollen die Gesundheit des Menschen und von ihm hergestellte Produkte schützen. Dazu gehören beispielsweise Desinfektionsmittel, Holzschutzmittel oder Rattengifte. Pflanzenschutzmittel wirken zwar auch biozid, schützen aber Pflanzen und ihre Produkte. Biozide und Pflanzenschutzmittel haben dementsprechend unterschiedliche Einsatzorte.
Für beide Produktgruppen besteht EU-weit eine Zulassungs- und Registrierungspflicht. Zwei Verordnungen geben die dazu erforderlichen Daten an, und zwar die EU-Verordnung Nr. 528/2012 über die Bereitstellung auf dem Markt und die Verwendung von Biozidprodukten sowie die EU-Verordnung Nr. 1107/2009 über das Inverkehrbringen von Pflanzenschutzmitteln. Wie die gesetzlichen Regelungen für Chemikalien geben die Verordnungen vor, die Zahl der notwendigen Tierversuche möglichst klein zu halten und keine Wirbeltiere zu verwenden. Ebenfalls sollen für Produkte bereits vorliegende Testdaten von den Herstellern mehrfach genutzt werden.
Das deutsche Tierschutzgesetz setzte 1986 ein erstes Verbot für Tierversuche in diesem Bereich fest. Damals galt: Sofern geeignete Alternativmethoden bestanden, duften Tierversuche in Deutschland nicht dazu herangezogen werden, um die gesundheitliche Unbedenklichkeit nachzuweisen. Dies betraf zunächst jedoch nur dekorative Kosmetika und nicht pflegende Produkte. 1998 wurde die entsprechende Bestimmung auch auf pflegende Produkte erweitert.
2004 wurde in der EU erstmalig ein Tierversuchsverbot für kosmetische Fertigprodukte eingeführt. Allerdings blieben zu diesem Zeitpunkt noch Tests von einzelnen Bestandteilen an Tieren von diesem Verbot ausgeschlossen. 2009 ging die EU einen Schritt weiter: Mit der Verordnung Nr. 1223/2009 verfügte sie ein grundsätzliches Verbot für Tierversuche im Zusammenhang mit Kosmetika. Das Verbot schließt seitdem kosmetische Fertigerzeugnisse ebenso ein wie Bestandteile und Kombinationen von Komponenten.
Seit März 2013 sind sämtliche an Tieren getestete Kosmetika inklusive ihrer Vermarktung in der EU verboten. Dieses Verbot gilt unabhängig davon, ob das jeweilige Produkt aus einem der Mitgliedsländer oder einem Drittstaat stammt. Im September 2016 weitete der Europäische Gerichtshof diesen Tierschutzgedanken aus: Wenn zum Beispiel die Unbedenklichkeit von Kosmetik-Bestandteilen in der EU nachgewiesen werden soll, dürfen dafür nicht Daten aus Tierversuchen verwendet werden, die für Zulassungsverfahren in Nicht-EU-Ländern erhoben worden sind. Die Richter*innen wollen mit ihrer Entscheidung verhindern, dass das geltende Tierversuchsverbot für Kosmetika in der EU mit Tests außerhalb der EU umgangen wird; sie stellten ausdrücklich klar, dass der Zugang zum EU-Markt für Kosmetikprodukte an das Tierversuchsverbot geknüpft ist.
Tests zur Giftigkeit (Toxizität) von Komponenten bleiben von dem Verbot allerdings teilweise weiterhin ausgenommen: Da viele Inhaltsstoffe von Kosmetika ebenso in anderen Produkten enthalten sind, unterliegen sie dem Chemikalienrecht (REACH, s.o.). Dieses sieht innerhalb der toxikologischen Prüfung Tierversuche vor, um Gefahren für die Gesundheit bei der Produktion und Handhabung auszuschließen.
Ausführliche Informationen finden Sie auf unserer Themenseite Kosmetik.






