Dr. Michael Melzer ist Wissenschaftler an der Universität Ulm. Für seine Forschung wurde ihm nun der URSULA M. HÄNDEL-Tierschutzpreis verliehen. Dr. Melzer entwickelt sogenannte Organmodellsysteme um damit die Entstehung und Entwicklung von Tumoren in der Bauchspeicheldrüse ohne den Einsatz von Tierversuchen erforschen zu können. Dafür nutzt er die Harnblasen von ohnehin für die Lebensmittelproduktion geschlachteten Schweinen. Auf diesen wiederum züchtet er stammzellenbasierte Bauchspeicheldrüsen-Zellen (sog. Pankreaszellen) und beobachtet sodann ihre Reifung, Veränderung, aber auch die Invasion von Tumorzellen.
Das Organmodellsystem von Dr. Melzer leistet einen wichtigen Beitrag zur Verringerung von Tierversuchen, denn es hilft dabei den Einsatz von Mäusen in der Pankreas-Forschung auf ein absolut notwendiges Maß zu beschränken.
Wie funktioniert das von Ihnen entwickelte Verfahren?
Wir haben das Schweineharnblasenorgankulturmodell im Bereich der Pankreaskarzinogenese und -organogenese (d.h. die Entstehung der Bauchspeicheldrüse sowie die Entwicklung von Tumoren in der Bauchspeicheldrüse) implementiert und optimiert. Dabei werden Schweineharnblasen nach der regulären Schlachtung von Mastschweinen erworben und im Labor prozessiert.

Nach einer ausführlichen Säuberung und enzymatischer und mechanischer Entfernung der uro-epithelialen Zellschicht werden die ganzen Blasen in kleinere Stücke geschnitten, sodass aus einer Blase ca. 30 Stücke gewonnen werden. Diese werden in einem Air-Liquid-Interface-Zellkultursystem kultiviert. Anschließend werden die Zellen auf den Harnblasen ausgesät und für einen bestimmten Zeitraum kultiviert.
Dabei kann der Zeitraum individuell festgelegt werden, sodass eine präzise zeitliche Auflösung der jeweiligen Fragestellung (Reifung von Zellen, phänotypische Veränderungen, Invasion, Zell-Zell-Interaktionen, etc.) möglich ist. Zum gewünschten Zeitpunkt werden die Engraftments der Zellen dann untersucht.
Insbesondere bei transgenen Mausmodellen fallen viele Tiere mit dem nichtgewünschten Genotypen an, sodass ein Überschuss an Mäusen produziert wird. Der Einsatz des Modells verringert die Anzahl von nicht verwendbaren Tieren in der Krebs- und Stammzellforschung.
Worin liegt der Unterschied zum bisherigen Verfahren?
Das neue Verfahren dient als Ersatz für unterschiedliche andere Verfahren. Zum einen werden reine in vitro Untersuchungen (d.h. außerhalb lebender Organismen im „Reagenzglas“) mit dem Organkulturmodellsystem durch verschiedene neue Aspekte aufgewertet. Es kommt zu einer verbesserten Reifung von stammzellbasierten Pankreaszellen.
Zudem können Invasion und Zell-Zell-Interaktionen untersucht werden. Außerdem wird deutlich weniger in Mäusen produziertes Matrigel bzw. andere extrazelluläre Matrizes verwendet als bei konventionellen Organoidkulturen. Zur Untersuchung der Pankreasentwicklung aus Stammzellen hatten wir zur finalen Ausbildung reifer Pankreasstrukturen und Expression von Maturierungsmarkern bis dato eine Transplantation in murine Pankreata durchgeführt.
Und welche Vorteile bietet die Verwendung von Schweineharnblasen?
Die Verwendung der Schweineharnblase ermöglicht hier den Ersatz der technisch aufwendigen orthotopen Transplantationen und bedarf zudem keiner Maus für die Transplantation zur Untersuchung der Reifung stammzellbasierter Pankreaszellen. Die Invasion von Tumorzellen bei Pankreaskarzinomen wurde mangels guter Alternativen ebenfalls in vivo (d.h. im lebendigen Organismus) beurteilt. Mit der Schweineharnblase verwenden wir ein Modellsystem, das auch diesen Aspekt der Tumorbiologie beleuchten kann. Somit unterscheidet sich die Schweineharnblase sowohl von in vitro als auch in vivo Versuchen insofern, als weniger Matrigel und Mäuse verwendet werden müssen.
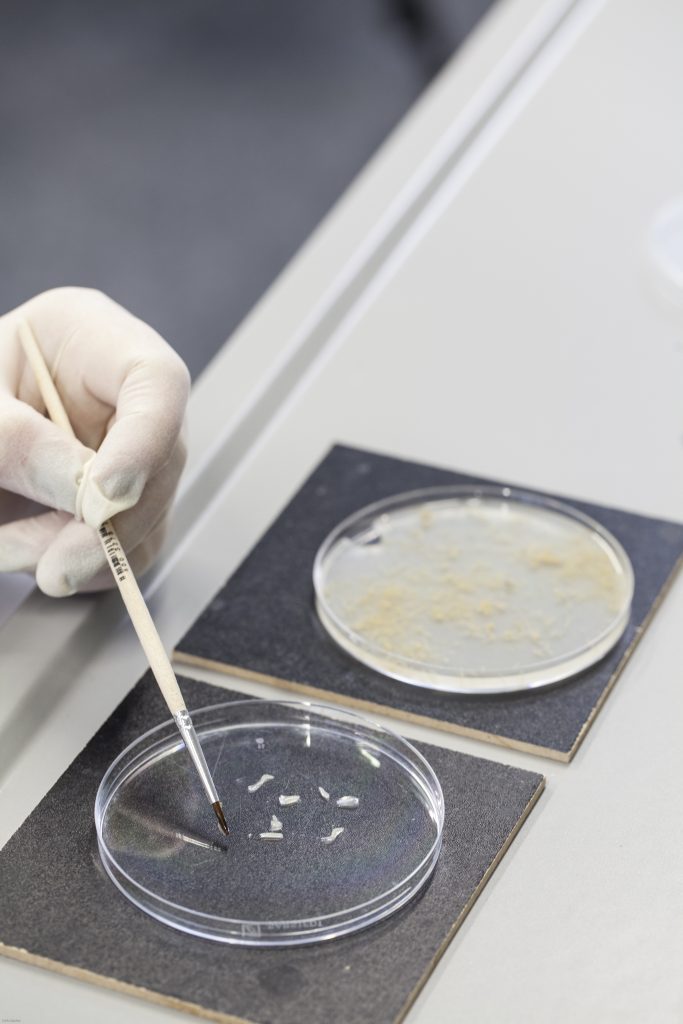
Bei den Schweineharnblasen handelt es sich um Organe, die von Schweinen stammen, die im Rahmen der Lebensmittelproduktion getötet wurden. Müssen die Harnblasen vorher noch gesondert präpariert werden?
Die Schweineharnblasen werden nicht gesondert präpariert. Sie werden im Rahmen der Schlachtung entnommen und erst später im Labor besonders weiterprozessiert.
Durch die Covid-19-Pandemie kam es weltweit zu Engpässen in der Matrigel-Produktion, sodass Organoidkulturen nicht aufrechterhalten werden konnten. Damit wurden ganze Arbeitsgruppen und Institute in ihrer Arbeit massiv behindert.
Wie wird Matrigel hergestellt und welche Bedeutung hat die Verwendung von Matrigel für die Organoide?
Matrigel besteht aus der extrazellulären Matrix (EZM) von besonders EZM-reichen Engelbreth-Holm- Swarm-Sarkomen (EHS-Sarkome). Dabei werden die EHS-Sarkom-Zellen bzw. kleine Tumorstücke Mäusen subkutan implantiert. Sobald die Tumoren eine bestimmte Größe erreichen, werden sie wieder explantiert und die EZM aus den Tumorstücken aufgereinigt.
Matrigel ist dabei eine besondere Form dieser EZM. Zusammen mit anderen extrazellulären Matrizes, die auf ähnliche Weise präpariert werden, stellen sie den aktuellen Goldstandard für die Organoidkulturen dar. Diese EZM bilden dabei das extrazelluläre Stützgerüst für Zellen. So wird erst die Bildung von dreidimensionalen Organoiden ermöglicht. Matrigel und ähnliche Alternativen stellen somit die absolute Basis für eine erfolgreiche Organoidkultur dar.
| Was ist Matrigel? |
|---|
| Das sogenannte Matrigel ist ein Hydrogel mit speziellen Eigenschaften. Es wird aus der extrazellulären Matrix von Engelbreth-Holm-Swarm-Sarkomen gewonnen. Diese Sarkom-Zellen bzw. kleinere Tumorstücke werden Mäusen implantiert. Sobald die Tumoren eine entsprechende Größe erreichen, werden sie wieder entnommen und die extrazelluläre Matrix aufgereinigt. Neben anderen Matrizes, die auf ähnliche Weise gewonnen werden, stellt Matrigel eine weit verbreitete Formulierung dar. Matrigel ist dabei ein Hydrogel, das in gefrorenem Zustand gelagert wird. Durch seine spezielle proteinreiche Zusammensetzung ist es nur bei Temperaturen über dem Gefrierpunkt flüssig und nimmt bei höheren Temperaturen eine feste Form an. So eignet es sich als dreidimensionales Gerüst für Zellen, die in diesem Hydrogel sogenannte Organoide ausbilden können. |
Sehen Sie die Nutzung von Matrigel als Schwachstelle bei Organoiden?
Tatsächlich haben wir im Laufe der letzten zwei Jahre erfahren, wie groß die Abhängigkeit von Organoidsystemen von Matrigel oder vergleichbaren Matrizes ist. Durch die Covid-19-Pandemie kam es weltweit zu Engpässen in der Matrigel-Produktion, sodass Organoidkulturen nicht aufrechterhalten werden konnten. Damit wurden ganze Arbeitsgruppen und Institute in ihrer Arbeit massiv behindert.
Zudem ist die genaue Zusammensetzung von Matrigel nur sehr schwer zu kontrollieren und kaum standardisierbar, da es sich um ein komplexes biologisches Produkt handelt. Durch die große Batch- to-Batch Varianz von Matrigel kommt es daher auch zu einem maßgeblichen Einfluss auf die Reproduzierbarkeit von Ergebnissen in Organoidmodellen. Somit bestehen bei der Verwendung von Matrigel oder ähnlichen Hydrogelen relevante Schwachstellen.
Das Modellsystem hilft dabei, Mausversuche auf ein absolut notwendiges Maß zu beschränken.
Welche Vorteile bietet die von Ihnen entwickelte Methode auch im Hinblick auf nicht verwendbare Tiere in der Krebsforschung?
Insbesondere bei transgenen Mausmodellen fallen viele Tiere mit dem nichtgewünschten Genotypen an, sodass ein Überschuss an Mäusen produziert wird, der für die jeweilige Fragestellung irrelevant ist. Insbesondere bei Pankreaskarzinomen sind dabei viele verschiedene Gene von Interesse, sodass es verschiedenste Mausstämme gibt. Mit jedem zusätzlichen, untersuchten Gen in der Kolonie einer Arbeitsgruppe verringert sich die Wahrscheinlichkeit, Mäuse mit relevantem Genotyp aus den entsprechenden Verpaarungen zu bekommen.
Mit dem Organkulturmodellsystem verwenden wir Zellen und Organoide, die zuvor in vitro kultiviert wurden. Durch Kombination mit State-of-the-Art Geneditierungstechniken kann zudem nahezu jeder Genotyp von Interesse untersucht werden, sodass aufwendige Verpaarungen mit Mäusen ohne relevanten Genotyp entfallen. Somit verringert sich bei Einsatz des Modellsystems die Anzahl von nicht verwendbaren Tieren in der Krebs- und Stammzellforschung.
Inwieweit kann die Verwendung von Schweineharnblasen die Zahl eingesetzter Mäuse reduzieren bzw. ersetzen?
Wir konnten in unserer Arbeit zeigen, dass die Kultur von stammzellbasierten Pankreaszellen auf der Schweineharnblase möglich ist. Zudem kommt es zu einer Reifungsgrad, den wir zuvor nur nach orthotoper Transplantation in das Pankreas der Maus beobachten konnten. Insofern können wir die Schweineharnblase als geeignetes Modellsystem verwenden, um die Ausreifung der verschiedenen Zelltypen des Pankreas ohne Verwendung von Mäusen zu untersuchen.
Weiterhin eignet sich die Schweineharnblase als Modell zur Untersuchung komplexer Ko-Kulturen. Wenn Zellen in vitro in Ko- Kulturen untersucht werden, ist die Dichte der Zellen ein limitierender Faktor. Die Zellen wachsen in der Ko-Kultur weiter und werden relativ schnell so dicht, dass eine suffiziente Versorgung mit Nährstoffen nicht mehr gewährleistet ist. Die Zellen sterben dann ab, bzw. müssen vorher wieder gesplittet werden, sodass langfristige Untersuchung von Zell-Zell-Interaktionen in Organoidsystemen in vitro sehr schwierig umzusetzen sind.
Durch die Honorierung in der Welt der Wissenschaft und insbesondere natürlich auch durch den URSULA M. HÄNDEL-Preis wird offensichtlich, dass Tierversuche keine notwendige Voraussetzung für wissenschaftlich wertvolle Arbeiten sind.
Und diese Schwachstelle besteht bei dem System auf der Schweineharnblase nicht?
Nein, bei Kultur von Zellen und Organoiden in komplexen Ko-Kultur-Systemen auf der Schweineharnblase haben wir diese Eigenschaften nicht beobachtet. Sondern, ganz im Gegenteil, es bildeten sich komplexe Netzwerke miteinander interagierender Zellen, die in unserem Fall ein komplexes, sehr dichtes Tumor-Stroma-Netzwerk mit lebenden Zellen entwickelten, wie wir es zuvor nur in vivo beobachten konnten.
Gleiches konnten wir auch für Monokulturen beobachten, bei denen sich die Zellen auf der Schweineharnblase anders verhalten und nicht gesplittet werden mussten, sodass auch langfristige Beobachtungen in einem System mit maximaler Zugänglichkeit möglich sind. Im Vergleich zu Mausversuchen können wir tatsächlich sehr leicht wieder an die verwendeten Zellen gelangen und eine zeitliche Auflösung herstellen, für die wir sonst für jeden Zeitpunkt eine eigene Maus bräuchten. Insofern bietet die Schweineharnblase ein starkes Modellsystem, um Mausversuche auf ein absolut notwendiges Maß zu beschränken.
Wie lange haben Sie an dem Verfahren geforscht? Was sind die nächsten Schritte?
An der Implementierung der Schweineharnblase zur Verwendung bei der Untersuchung des Pankreasentstehung und Krebsentwicklung haben wir zwei Jahre geforscht. Aktuell erweitern wir die Anwendungsmöglichkeiten auf Krebszelllinien von Pankreaskarzinomen, verschiedene Stromazelltypen und standardisieren die Methodik weiter und bereiten ein detailliertes Schritt-für- Schritt-Protokoll vor, um so auch anderen Arbeitsgruppen einen leichten Zugang zur Methodik zu ermöglichen.
Wie lange dauert es, bis das Verfahren als tierversuchsfreie Technologie zugelassen wird?
Aktuell erwerben wir die Schweineharnblasen in einem Schlachtbetrieb. Das Verfahren als solches findet also tierversuchsfrei statt. Die Organkulturmethodik für Pankreaskarzinome als solche haben wir publiziert, nicht patentiert und bereiten aktuell eine Schritt-für-Schritt-Anleitung vor, sodass jeder, der das entsprechende Interesse hat, auf die Technik zurückgreifen kann.
Obwohl das Schweineharnblasenmodell vielfach komplementär zu Tierversuchen eingesetzt werden kann, wird es Tierversuche nicht vollständig ersetzen können.
Bauchspeicheldrüsenkrebs gilt als eine der Krebsarten mit der niedrigsten Überlebensrate. Inwieweit können Patient*innen von der von Ihnen entwickelten Methode profitieren?
Zum einen können wir die Tumorbiologie durch Untersuchung des Einflusses verschiedener Gene im stammzellbasierten System in Kombination mit dem Organkulturmodell besser verstehen. Ein besseres Verständnis der Tumorbiologie ist immer Voraussetzung für die Entwicklung von Therapien. Insbesondere der hohe Stromaanteil ist beim Pankreaskarzinom ein Problem für effektive Therapien. Durch Verwendung komplexer Ko-Kulturen in Kombination mit dem Stroma des Organkultursystems können wir diesen Aspekt der Tumorbiologie und die Effekte potentieller Behandlungen auf das Stroma besonders gut untersuchen. Somit profitieren die Patienten indirekt von der Entwicklung des Systems.
Lässt sich das Verfahren auch auf andere Tumorarten übertragen?
Die Schweineharnblase als Organkulturmodell wird bereits auch bei Urothelkarzinomen für Invasionsexperimente verwendet. Dort ist die Verwendung naheliegend, da es sich um das gleiche Organ handelt. Bei anderen Tumorarten neben dem Pankreaskarzinom besteht gegebenenfalls die Möglichkeit das System zu etablieren. Allerdings ist ohne Vorversuche unklar, ob andere Tumorarten ebenfalls ein biologisch relevantes Verhalten auf der Schweineharnblase abbilden. Insofern bedarf es wahrscheinlich einiger Anpassungen. Neben Studien zur Tumorentstehung kann die Schweineharnblase aber auch als Modell zur Untersuchung der Organentwicklung mithilfe stammzellbasierter Systeme verwendet werden.
Inwieweit ist der URSULA M. HÄNDEL-Preis Ansporn weiter an Alternativen zu Tierversuchen zu forschen?
Der Tierschutzpreis, sowie die Akzeptanz des Systems auch bei Fach-Gutachten im Rahmen unserer Veröffentlichungen, spornt enorm an, um auch weiter Tierversuche zu reduzieren. Durch die Honorierung in der Welt der Wissenschaft und insbesondere natürlich auch durch den URSULA M. HÄNDEL-Preis wird offensichtlich, dass Tierversuche keine notwendige Voraussetzung für wissenschaftlich wertvolle Arbeiten sind. Insofern gibt es bei guten Alternativen keine unbedingte Notwendigkeit für die Durchführung von Tierversuchen, die trotz aller Vorteile auch immer Nachteile (kein humanes System, anderes Immunsystem, tlw. ganz andere Genprogramme, etc.) mit sich bringen. Aktuell fehlen aber leider für manche Fragestellungen gute Alternativen, sodass weiterhin eine Motivation besteht, die existierenden Lücken zu schließen. Obwohl das Schweineharnblasenmodell vielfach komplementär zu Tierversuchen eingesetzt werden kann, wird es Tierversuche nicht vollständig ersetzen können. Jedoch besteht durch die erfolgte Honorierung ein zusätzlicher Anreiz, das Ganze weiter voranzutreiben, da evident wird, dass auch finanzielle Mittel für diese Art der Forschung zur Verfügung stehen.






