Nicht alle Tierversuche sind gleichwertig auf den Menschen übertragbar und führen am Ende zur Entwicklung neuer Therapien. Als Gründe hierfür werden oftmals fehlende Gemeinsamkeiten zwischen Mensch und Tier, Zahlen oder Statistiken genannt. Die Initiative Tierversuche verstehen prüft in der „Faktencheck-Reihe“ vier Behauptungen zur Übertragbarkeit von Ergebnissen aus Tierversuchen auf ihre Stichhaltigkeit.
Behauptung 4:
„58.000* Menschen sterben jedes Jahr in Deutschland an unerwünschten Nebenwirkungen von zugelassenen Medikamenten, die im Tierversuch für sicher befunden wurden!“
Todesfälle durch Nebenwirkungen zugelassener Medikamente, hier bei uns? Das Problem existiert tatsächlich. Doch wie groß ist es wirklich und was genau läuft schief? Prof. Dr. Harald Dormann sucht mit dem Team der ADRED-Studie nach Antworten. Der Facharzt für Innere Medizin ist Chefarzt der Zentralen Notaufnahme (ZNA) am Klinikum Fürth und Mitglied der Arzneimittelkommission der Deutschen Ärzteschaft (AkdÄ). Er ordnet ein, woher die Probleme stammen und wie sie sich vermindern ließen.
Wann wird ein neues Medikament zugelassen?
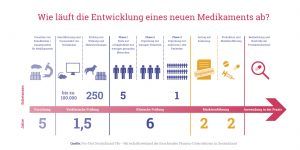
Bevor ein neues Medikament zugelassen werden kann, müssen mehrteilige sogenannte klinische Studien durchgeführt werden. Die klinischen Studien selbst stellen den ersten und entscheidenden Test am Menschen dar, denn die Zulassung eines neuen Arzneimittels beruht hauptsächlich auf den Ergebnissen dieser Studien. Um die Menschen, die an solchen Studien teilnehmen, bestmöglich zu schützen, wird der Großteil potentiell gefährlicher Wirkstoffkandidaten schon aussortiert, bevor Menschen damit in Berührung kommen, d.h. vor der ersten Phase einer klinischen Studie. Das geschieht vor allem durch in vitro- und in silico-Screenings oder Vergleichen mit ähnlichen, bereits bekannten Stoffen („Read across“), aber auch durch den Einsatz von Tierversuchen.
Nach Abschluss der dritten Phase einer klinischen Studie sind in der Regel Hunderte oder sogar Tausende Menschen dem neuen Wirkstoff ausgesetzt gewesen. Wenn dabei Nebenwirkungen auftreten, werden diese zusammen mit der Häufigkeit ihres Auftretens erfasst und später von den Zulassungsbehörden gegen den Nutzen des neuen Wirkstoffs abgewogen. Die Informationen tauchen auch auf dem Beipackzettel auf. Doch selbst solche umfassenden Versuche an Menschen können nicht garantieren, dass bei anderen Menschen nicht noch weitere, möglicherweise dramatische Nebenwirkungen auftreten. Genauso wenig kann die Zulassung eines Medikaments für den einzelnen Patienten garantieren, dass das Medikament auch tatsächlich so wirkt wie es soll.
Wie groß ist das Problem?
Das Problem von schwerwiegenden unerwünschten Arzneimittelwirkungen (UAW), wie Nebenwirkungen im Fachjargon heißen, existiert also tatsächlich. Doch wie groß ist es wirklich und was genau läuft schief? Diesen Fragen gehen Ärztinnen und Ärzte seit Ende 2015 in der groß angelegten ADRED-Studie unter Leitung des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) nach. Die ersten Ergebnisse, veröffentlicht Anfang 2018 im Deutschen Ärzteblatt, sind beachtlich:
An den 30 Tagen des Untersuchungszeitraums wurden in vier großen deutschen Kliniken 6,5 % aller Einlieferungen in die Notaufnahme (10.174 untersuchte Fälle) mit dem Verdacht auf eine UAW in Verbindung gebracht. Unter den Patienten, bei denen eine Medikamenteneinnahme bekannt war, waren es sogar 12 %.
Größenordnungsmäßig bestätigen die Zahlen der ADRED-Studie, was aus früheren Untersuchungen abgeschätzt worden war. Damit zählen UAW zu den häufigen Gründen für gesundheitliche Beeinträchtigungen, die schwer genug sind, um einen ungeplanten Besuch in der Notaufnahme herbeizuführen. Weitere Ergebnisse und Auswertungen mit weitaus größeren Fallzahlen sollen folgen, um diese ersten Ergebnisse abzusichern.
Die im Titel zitierte Aussage bezieht sich explizit auf Todesfälle. Allerdings ist die Zahl der Todesfälle, die tatsächlich nachweislich auf das Konto von Nebenwirkungen zugelassener Medikamente gehen, trotz aufwändiger Bemühungen wie der ADRED Studie nur sehr schwer zu benennen. Häufig lässt sich kein direkter, kausaler Zusammenhang zwischen der Einnahme eines Medikaments und den Symptomen, die zur Einlieferung in eine Notaufnahme führten, herstellen. In der ADRED Studie konnten nur 2 % aller UAW-Verdachtsfälle tatsächlich kausal einer UAW zugeschrieben werden – für die meisten der untersuchten Fälle war eine UAW als Ursache entweder „möglich“ (82 %) oder „wahrscheinlich“ (16 %).
Was wissen wir über unsere Medikamente?
Wissen wir also zu wenig über die Eigenschaften zugelassener Medikamente? Oder sind die vorhandenen Daten vielleicht irreführend? Prof. Dr. med. Harald Dormann ist Chefarzt am Klinikum Fürth und ist an der ADRED-Studie beteiligt. Er erteilt pauschaler Kritik an der Arzneimittelsicherheit eine klare Absage: „Ganz generell würde ich sagen, dass unsere Medikamente sicher sind. Bildlich gesprochen, sitzen wir auf einem Haufen guter Daten, die wir aus den präklinischen und klinischen Studien gewinnen. Aber wir müssen dieses Wissen auch anwenden – und das passiert leider in der klinischen Praxis immer noch nicht gut genug.“
Tatsächlich lässt sich ein Teil der Klinikeinlieferungen, die nachweislich aus schweren Nebenwirkungen entstehen, auf Medikationsfehler zurückführen, wie zum Beispiel unerwünschte Wechselwirkungen bei der Kombination verschiedener Arzneimittel, falsche Dosierung oder Verschreibung eines Medikaments trotz Kontraindikation. „Nicht nur Rezeptpflichtige sondern auch freiverkäufliche Medikamente, wie etwa Schmerzmittel wie Acetylsalicylsäure, Paracetamol oder Ibuprofen, fallen uns in der Notaufnahme immer wieder negativ auf, weil es zu Überdosierungen kommt oder Wechselwirkungen ignoriert werden.“, sagt Dormann. Beispielsweise wüssten viele Patienten nicht, dass Ibuprofen die Aspirin®-Wirkung zur Blutplättchenhemmung bei gleichzeitiger Einnahme blockiert und damit den therapeutischen Effekt von Acetylsalicylsäure zur Herzinfarkt- oder Schlaganfallprophylaxe nicht entfalten kann. Auch eine deutliche Dosissteigerung von Paracetamol zur Schmerzlinderung führe eben nicht zu einer zusätzlichen Schmerzreduktion, sondern zu einer lebensbedrohlichen Leberschädigung. In der ADRED-Studie fanden die Ärzte besonders häufig Blutgerinnungshemmer, Bluthochdruckmedikamente und Psychopharmaka unter den mutmaßlichen Übeltätern.
Medikationspläne sollen Abhilfe schaffen
Und ein weiteres Problem benennt Dormann: „Unsere Studie zeigt, dass Patienten, bei denen wir davon ausgehen, dass sie aufgrund einer Nebenwirkung in die Notaufnahme kommen, im Schnitt etwa sieben, in Einzelfällen aber sogar bis über 18 unterschiedliche Wirkstoffe gleichzeitig einnehmen.“ Hinzu komme, dass nicht alle Patienten im Notfall in der Lage sind, sich an ihre vollständige Medikation zu erinnern. Besonders ältere Patienten seien davon betroffen. „Ältere Menschen nehmen häufiger mehrere Medikamente zusammen ein und sind auf Grund ihrer körperlichen Konstitution und ihres Gesundheitszustandes außerdem anfälliger für unerwünschte Nebenwirkungen“, erklärt Dormann.
Um Anwendungsfehlern und Risiken bei gleichzeitiger Einnahme mehrerer Medikamente vorzubeugen fordert Dormann die flächendeckende und konsequente Nutzung des 2016 eingeführten bundeseinheitlichen Medikationsplans. Darauf haben Patienten Anspruch, wenn sie mindestens drei zulasten der gesetzlichen Krankenkassen verordnete, systemisch wirkende Medikamente gleichzeitig einnehmen oder anwenden. „In unserer Studie hatten zwar über 80 % einen Medikationsplan, aber bei nur etwa 10 % der Patienten war dieser auch ausreichend dokumentiert. Die Wahrscheinlichkeit von UAW aufgrund von Wechselwirkungen steigt mit der Zahl der Medikamente, die der Patient gleichzeitig einnimmt exponentiell.“, sagt Dormann. Hier könne ein Medikationsplan sowohl Ärzten als auch Patienten helfen, den Überblick zu behalten, welche Arzneimittel zu welchem Zweck eingenommen werden – vor allem wenn ein Patient von mehreren Ärzten behandelt wird, können so gefährliche Wechselwirkungen aufgrund unterschiedlicher Verordner transparent werden.
Fazit: Auch Menschen sind nur Modelle
Die Zulassung eines neuen Arzneimittels beruht hauptsächlich auf den Ergebnissen klinischer Studien, also Tests an gesunden Probanden und Patienten. Trotz der hohen Qualitätsstandards in der Medikamentenentwicklung lassen sich jedoch insbesondere seltene Nebenwirkungen nicht vollständig ausschließen. Denn selbst die Probanden und Patienten der klinischen Studien sind immer nur „Modelle“ für oft ganz individuelle Krankheitsverläufe und –ursachen. Alle Ärzte und Apotheker sind verpflichtet ihnen bekannt gewordene schwere oder seltene UAW auch nach Zulassung des Medikaments an die Bundesoberbehörde im Rahmen einer sogenannten Spontanerfassung zu melden. Häufen sich bestimmte Meldungen kann die Zulassungsbehörde reagieren und auch Medikamente erneut prüfen lassen oder sogar die Zulassung entziehen.
Bei einigen Medikamenten werden Nebenwirkungen sogar bewusst in Kauf genommen, weil der Nutzen höher als das Risiko bewertet wird (z.B. bei Chemotherapeutika zur Behandlung von Krebs). Andererseits sind viele Nebenwirkungen, wenn sie auf Anwendungsfehlern beruhen, vermeidbar; hier liegt das Problem also in der Patientenversorgung – und nicht primär in zu wenig oder falscher Forschung.
Der Ruf nach „relevanteren Modellen, die sich am Menschen orientieren“, oder sogar – wie vielfach in sozialen Medien vorgebracht – nach Experimenten mit Straffälligen („Stoppt Tierversuche, nehmt Kinderschänder!“), um damit Nebenwirkungen zu verhindern, besteht den Realitätscheck also nicht.
Viel wichtiger: Jeder kann selbst dazu beitragen, Nebenwirkungen an die Behörden zu melden und damit den Einsatz von Medikamenten sicherer zu machen. Das geht über dieses Formular: https://nebenwirkungen.pei.de/nw/DE/home/home_node.html.
Außerdem haben Patienten seit Oktober 2016 Anspruch auf den bundeseinheitlichen Medikationsplan, wenn sie mindestens drei zulasten der gesetzlichen Krankenkassen verordnete, systemisch wirkende Medikamente gleichzeitig einnehmen oder anwenden – und sollten Ihren Arzt danach fragen.
*Bei dieser Zahl handelt es sich um einen Schätzwert, den zwei deutsche Forscher aus einer US-amerikanischen Studie aus dem Jahr 2001 abgeleitet haben.
Weiterführende Informationen & Links:
Video über die ADRED-Studie und Zusammenfassung der im Text geschilderten Probleme: „Notfall Wechselwirkung“ ([W] wie Wissen, ARD)
https://www.rbk.de/aktuelles/adred-studie.html
https://www.pharmazeutische-zeitung.de/index.php?id=75710
Weitere Beiträge, in denen die Initiative andere Behauptungen auf Stichhaltigkeit prüft und die Bedeutung von Ergebnissen aus Tierversuchen für die Humanmedizin beleuchtet, finden Sie hier.






