 Die Parkinson-Forschung hat in den vergangenen Jahren große Fortschritte gemacht. Prof. Andrea Kühn von der Charité in Berlin und Prof. Jens Volkmann vom Universitätsklinikum Würzburg gehören zu den führenden Forschenden auf diesem Gebiet. Sie arbeiten an der weiteren Verbesserung der Tiefen Hirnstimulation (THS). Bei dieser Therapieoption werden Nervenzellen im Zentrum des Gehirns mit elektrischem Strom gezielt angeregt. Ihre Erkenntnisse sollen zudem helfen, die Stimulation mit Hilfe von Elektroden in der Parkinson-Therapie auch auf andere Bewegungsstörungen auszuweiten. Im Gespräch mit „Tierversuche verstehen“ sprechen die beiden Forschenden im Rahmen des Projekts #meinwunderpunkt über die Tiefe Hirnstimulation, geben Einblicke in die Entwicklung der Forschung und erklären, warum es in der Hirnforschung noch dauern wird, bis Computermodelle Tierversuche ersetzen.
Die Parkinson-Forschung hat in den vergangenen Jahren große Fortschritte gemacht. Prof. Andrea Kühn von der Charité in Berlin und Prof. Jens Volkmann vom Universitätsklinikum Würzburg gehören zu den führenden Forschenden auf diesem Gebiet. Sie arbeiten an der weiteren Verbesserung der Tiefen Hirnstimulation (THS). Bei dieser Therapieoption werden Nervenzellen im Zentrum des Gehirns mit elektrischem Strom gezielt angeregt. Ihre Erkenntnisse sollen zudem helfen, die Stimulation mit Hilfe von Elektroden in der Parkinson-Therapie auch auf andere Bewegungsstörungen auszuweiten. Im Gespräch mit „Tierversuche verstehen“ sprechen die beiden Forschenden im Rahmen des Projekts #meinwunderpunkt über die Tiefe Hirnstimulation, geben Einblicke in die Entwicklung der Forschung und erklären, warum es in der Hirnforschung noch dauern wird, bis Computermodelle Tierversuche ersetzen.
Weitere Informationen zum Projekt #meinwunderpunkt gibt es hier.
Ist jeder Patient für die Therapie mittels Tiefer Hirnstimulation geeignet? Welche Voraussetzungen müssen Patienten mitbringen?
Prof. Andrea Kühn: Bestimmte Patienten sind besonders gut für die Tiefe Hirnstimulation geeignet. Es sind Patienten bei denen im Tagesverlauf Schwankungen in der Beweglichkeit auftreten, die mit verfügbaren Medikamenten nicht mehr gut genug behandelt werden können. Es sollten keine relevanten kognitiven Störungen vorliegen, ebenso wie keine schweren akuten depressiven Episoden oder andere ausgeprägte psychiatrische Begleiterkrankungen. Auf der anderen Seite können Medikamente aber auch unkontrollierte Verhaltensauffälligkeiten auslösen. Dann kann man über eine Therapie mit der Tiefen Hirnstimulation nachdenken.
Welche Erkenntnisse gibt es darüber, wie sich die Lebensqualität durch den Eingriff verändert?
Prof. Kühn: Es gibt einen Fragebogen zur Erfassung der Lebensqualität von Parkinson-Patienten, den sogenannten PDQ-39. Hier wurde bei den Patienten eine Verbesserung von etwa 25 Prozent in verschiedenen Lebensbereichen festgestellt. Es geht hier ja nicht nur um die Beweglichkeit, die zu einer erhöhten Lebensqualität beiträgt, sondern auch um emotionales Wohlbefinden. Wir erfahren das auch im täglichen Umgang mit unseren Patienten. Grundsätzlich spielt hier auch die vorherige Aufklärung der Patienten eine Rolle, damit keine falschen Hoffnungen und Erwartungen geweckt werden.

Ein Beispiel: Eine ältere Parkinson-Patientin, die ein sehr ausgeprägtes Zittern hatte. Wir nennen das Tremor. Sie ist für ihr Leben gerne in die Philharmonie gegangen und hatte dazu immer ein Kissen dabei, was sie sich unter die Füße gelegt hat, um das Zittern abzufedern. Sie fühlte sich aber natürlich mehr und mehr unwohl und besuchte schließlich keine Konzerte mehr. Nach der Operation mit der Tiefen Hirnstimulation ist sie als erstes wieder in die Philharmonie gegangen.
Welche Rolle spielten Tierversuche bei der bisherigen Entwicklung der Tiefen Hirnstimulation?
Prof. Jens Volkmann: Die Entwicklung der THS ist eine Erfolgsstory der Umsetzung von Laborergebnissen in die medizinische Praxis, also der translationalen Forschung. Ein Meilenstein war 1990 die Arbeit von Hagai Bergman und Kollegen. Sie zeigten an zwei Affen, dass eine Störung in der Gehirnregion des Nucleus subthalamicus für das Zittern (Tremor), die Muskelsteifheit (Rigor) und, die Verlangsamung von willkürlichen Bewegungen (Akinese), verantwortlich ist. Bis zu diesem Zeitpunkt hatte man die Akinese für einen Funktionsverlust im Gehirn gehalten. Es galt somit bis dahin als unmöglich, die Bewegungsfähigkeit durch chirurgische Eingriffe zu verbessern. Bergmans Arbeit hat aber erstmals nachgewiesen, dass die Akinese nicht durch eine verminderte, sondern durch eine gesteigerte Aktivität von Nervenzellen entsteht und diese kann man durch medizinische Eingriffe bremsen. 1992 gab es dann den Proof-of-Concept mit der ersten Tiefe Hirnstimulation-Operation in Grenoble (Frankreich). Blickt man auf die Parkinson-Erkrankung in den vergangenen 15 bis 20 Jahren, so bleibt eine der großen Fragen, wie man Nebenwirkungen wie Kontrollstörungen, Psychosen und Überstimulation bei Parkinson und auch bei anderen Bewegungsstörungen verhindern kann, die durch die Tiefe Hirnstimulation auftreten können.

Welche Tiere werden in der Parkinson-Forschung zur Entwicklung der Tiefen Hirnstimulation eingesetzt und warum?
Prof. Volkmann: Grundsätzlich werden für die Tiefe Hirnstimulation als Tiermodelle Ratten und Mäuse genutzt. Darüber hinaus werden selten Affen eingesetzt, jedoch nicht in Deutschland. Wir haben etwa durch Versuche an Ratten und Mäusen herausgefunden, dass die Tiefe Hirnstimulation als Alternative zur Medikation zu einem sehr frühen Zeitpunkt eingesetzt werden sollte, also wenn mildeste Nebenwirkungen der medikamentösen Therapie erkennbar sind. Wir arbeiten dabei mit der gezielten Injektion von speziell präparierten Viruspartikeln in das Gehirn der Tiere, um so bestimmte Aspekte der Krankheitsentwicklung von Parkinson nachzuvollziehen. Es geht dabei um die Ablagerung des Proteins Alpha-Synuclein im Gehirn, das auch beim Menschen im Zentrum der Erkrankung steht. Wenn diese Eiweiße krankhaft verklumpen, führt das zu einem langsam fortschreitenden Funktionsverlust im Nervensystem. Diese Nagetier-Modelle sind deswegen notwendig, weil wir das Nervensystem bei Tieren über einen längeren Zeitraum untersuchen können. Das können wir beim Menschen nicht. Wir wissen nicht, wie sich der Mangel an Dopamin über einen längeren Zeitraum verändert. Wir wissen nicht, wie viele Nervenzellen zu welchem Zeitpunkt abgestorben sind. Beim Tier können wir das durch Untersuchungen des Gewebes aber genau ermitteln. Ein weiterer Vorteil ist, dass sich beobachtbare Probleme in einer Maus oder Ratte zeitlich relativ rasch entwickeln.
Man erzeugt also in den Tieren künstlich eine Parkinson-ähnliche Erkrankung?
Prof. Volkmann: Genau. Eine erste Methode war es, Affen eine Substanz namens MPTP zu verabreichen. Dadurch sterben gezielt Dopamin-produzierende Zellen im Gehirn ab. Diese hatte auch zu dem zuvor genannten Durchbruch in den 1990er Jahren geführt. Das Problem beim MPTP-Modell ist aber, dass man lediglich einen einzelnen Aspekt der Parkinson-Krankheit untersuchen kann, nämlich die Netzwerkstörung durch Dopaminmangel. Es spiegelt nicht wider, wie dieser Dopaminmangel entsteht und warum die Nervenzellen absterben.
Gibt es heute bessere Modelle?
Prof. Volkmann: Wir wissen, dass sich bei chronischen neurodegenerativen Erkrankungen das Gehirn fortlaufend an die sich entwickelnde Störung anpasst. Das ist auch der Grund, warum erst relativ spät im Verlauf der Parkinson-Erkrankung die Symptome auftreten. Es müssen ja 60 bis 70 Prozent der Dopamin-produzierenden Zellen abgestorben sein, damit man überhaupt erstmal Dopmaninmangel-Symptome bei einem Patienten sieht. Das zeigt, dass der Krankheitsprozess schon lange läuft bevor Symptome auftreten, weil das Gehirn den Ausfall der Zellen noch eine ganze Weile kompensieren kann. Wenn man also untersuchen will, wie man diesen Verlauf beeinflussen oder die Nervenzellen gegen das Absterben schützen könnte, muss man genau diese Prozesse anschauen. Was passiert da eigentlich? Greift man direkt in den pathogenetischen Mechanismus, also die Ursache der Krankheit ein? Kann man die Kompensation mittels Tiefer Hirnstimulation stärken? Zur Beantwortung dieser Fragen verwenden wir Tiermodelle, bei denen der Krankheitsverlauf relativ gesehen ähnlich langsam voranschreitet. Solche Modelle gibt es mit Affen noch nicht. Vielleicht wird es sie geben, aber der Einsatz von nicht-menschlichen Primaten ist sehr aufwändig und extrem teuer. Affen eignen sich hier also nicht, um Studien mit größeren Tierzahlen durchzuführen. Proof-of-Concept-Studien wären da eher vorstellbar.
Was muss passieren, damit man auf Tierversuche in diesem Bereich verzichtet werden kann?
Prof. Volkmann: Was die Netzwerkfunktion angeht, das ist ja nun hinreichend geklärt. Da brauchen wir für die Parkinson-Erkrankung kaum mehr Tierversuche. Bei anderen Krankheiten hingegen sind diese Netzwerke noch nicht bekannt, da sind Tierversuche durchaus sinnvoll. Wir haben zum Beispiel mit Hilfe von Ratten gezeigt, dass die Stimulation in der Tiefe des Gehirns das Gehen nach einem Schlaganfall wieder verbessern kann. Das ist eine völlig neue Indikation. Es wird ein neuer Regelkreis untersucht, der gestört ist. Das muss man im Tierversuch etablieren.
Hirnorganoide sind mittlerweile auch in der Lage, Teile des Mittelhirns abzubilden. Das ist das Gehirnareal, das auch bei Parkinson eine zentrale Rolle spielt. Welche Methoden müssten vorhanden sein, damit man hier auf Tiermodelle verzichten könnte?
Prof. Volkmann: Eigentlich kann man da im Moment gar nicht drauf verzichten, weil es keine zellulären oder Organoid-Modelle gibt, die die Komplexität des Gehirns in seiner Gesamtheit widerspiegeln. Die Tiefe Hirnstimulation ist eine Modulation von Netzwerken des Gehirns, die von der Zell- über die Gewebeebene bis hin zu den großen Interaktionen zwischen den verschiedenen Hirnarealen aufgebaut sind. Die Tiefe Hirnstimulation hat Zugriff auf alle diese Ebenen. Man kann auf der allerkleinsten Ebene zwar zellbiologische Fragen beantworten, zum Beispiel: Wie ist das Zusammenspiel von elektrischem Strom mit Zellmembranen? Und das geschieht tatsächlich in Zellkulturen anhand von Platten mit Hunderten von Mikroelektroden, sogenannten Mikroelektroden-Arrays, Doch es spiegelt nicht die Komplexität eines Gesamtgehirns als Organ wider und es kann dann auch nicht Krankheitsmechanismen auf dieser systemischen Ebene in irgendeiner Form widerspiegeln.
Wie hat sich die Tiefe Hirnstimulation in den vergangenen Jahren weiterentwickelt?
Prof. Kühn: Eine ganz wesentliche Entwicklung ist zum einen der Einsatz von segmentierten, also im Ring unterteilte Elektroden, sodass man das elektrische Feld noch zielgerichteter platzieren kann. Damit können Nebenwirkungen noch besser vermieden werden und die Effektivität wird damit gesteigert. Der zweite wesentliche Punkt ist der Weg hin zur Entwicklung einer sogenannten Closed-Loop-Stimulation, also der Anpassung der Stimulation an die Aktivität im Gehirn. Im technischen Bereich sind auch die Stimulationsparameter noch weiter verbessert worden.
Prof. Volkmann: Ein ganz wesentlicher Punkt ist auch der Einsatz von digitalen Technologien bei der Tiefen Hirnstimulation. Diese haben zum Teil dazu geführt, dass man auf bestimmten Ebenen des Netzwerkes Computermodelle entwickeln kann, die dann auch therapeutische Vorhersagen ermöglichen. Die werden heute sogar schon zum Teil im klinischen Alltag eingesetzt. Es geht darum, dass man Modelle entwickelt, die beschreiben, wie sich der Strom ausbreitet und was er im Gewebe bewirkt.
Wie muss man sich das vorstellen?
Prof. Volkmann: Die Modelle basieren auf Zellmodellen von elektrisch erregbaren Membranen, die in bestimmter räumlicher Anordnung aus der individuellen Anatomie des Patienten entwickelt werden. Man kann aus einer Kernspin-Untersuchung die Lage der Elektrode und Lage der Strukturen, die im Gehirn stimuliert werden sollen, gewinnen. Durch eine anschließende Kombination mit Modellen der elektrischen Erregungsausbreitung lassen sich Vorhersagen treffen, wie der Strom wirken wird, wenn man ihn in bestimmten Richtungen um die Elektrode herumschickt. Diese Modelle sollen jetzt weiter ausgerollt werden. Vielleicht sind in der Zukunft einmal therapeutische Vorhersagen möglich. Vielleicht sind wir auch irgendwann in der Lage, dabei Tierversuche zu ersetzen. Aber da stehen wir noch ganz am Anfang.
Wie aufwändig ist so ein Verfahren?
Prof. Volkmann: Es geht darum, dass man erstmalig versucht, ein solches digitales Modell der Tiefen Hirnstimulation zu erstellen. Man kann sich sicherlich vorstellen, wie unglaublich komplex das ist. Dazu braucht man so etwas, wie ein virtuelles Gehirn mit all seinen funktionellen und strukturellen Verknüpfungen, um dann digital bestimmte Effekte des Stroms auf die Aktivität der Nervenzellen vorhersagen zu können. Das ist unter anderem eines der Teilprojekte in einem neuen Sonderforschungsbereich, den Frau Kühn und ich künftig leiten wollen.
Wie lange würde es dauern, bis man so ein Computermodell entwickelt hat?
Prof. Volkmann: Ein solches Computermodell ist verknüpft mit dem Versuch, im Rahmen des Human Brain Project vielfältigste Informationen über Verbindungen und Strukturen des menschlichen Gehirns in eine große Datenbank einzubringen, um eine Art Gehirnmodell zu entwickeln. Einige von diesen Entwicklungen versuchen wir auch für die Tiefe Hirnstimulation zu nutzen, um therapeutische Vorhersagen zu machen. Wann tatsächlich ein nutzbares Produkt vorliegen wird, da reden wir wahrscheinlich noch von Jahrzehnten. Es sind jetzt die ersten Anfänge, die wir machen.
Herzschrittmacher greifen inzwischen nur ein, wenn das Herz unregelmäßig schlägt. Die Tiefe Hirnstimulation wird oftmals als Hirnschrittmacher bezeichnet. Wird es hier auch einmal möglich sein, dass die Impulse nur dann erfolgen, wenn ein Bedarf festgestellt wird?
Prof. Kühn: Man nennt das auch adaptive Stimulation oder Closed-Loop-Stimulation. Wir versuchen in unserer Forschung, den richtigen Biomarker zu finden, also ein Signal des Gehirns, wann und wie die Stimulation einsetzen muss. Beim Herz ist das sehr viel einfacher umzusetzen, weil ein Herzschrittmacher über das EKG sehr gut ablesen kann, wann er eingreifen muss.
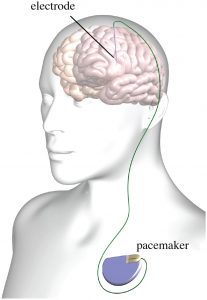
Das ist für die Tiefe Hirnstimulation sehr viel komplexer. Wir haben herausgefunden, dass ein bestimmtes Aktivitätsmuster im Gehirn, die so genannte Beta-Aktivität des Gehirns, so ein Biomarker sein könnte. Denn die Stärke der Parkinson-Symptome korreliert mit der Stärke dieser Beta-Aktivität. Wir wollen, dass die Stimulation oberhalb einer gewissen Schwelle der Beta-Aktivität einsetzt und diese dann unterdrückt. Das bedeutet, dass unterhalb der Schwelle keine Stimulation erfolgt. Doch das ist sehr viel komplizierter als bei einem Herzschrittmacher. Und für die anderen Erkrankungen, die auch mit der Tiefen Hirnstimulation behandelt werden, wie Dystonie, Tourette oder Depression ist es noch sehr viel unklarer, welche Biomarker wir nutzen können, die die entsprechenden Krankheitssymptome gut widerspiegeln. Sie müssen dann wissen: Jetzt ist die Stimulation erforderlich; oder: Jetzt müssen wir sie zurückfahren. Das zu optimieren ist unser Hauptforschungsthema.
Die Tiefe Hirnstimulation wird auch als Behandlungsoption für andere neurologische Erkrankungen erforscht. Wie weit ist man dort?
Prof. Kühn: Die Tiefe Hirnstimulation wird ja auch für andere Bewegungsstörungen wie Dystonie und Tremor genutzt. Eine große nationale Studie, die Herr Volkmann geleitet hat, hat letztlich zur Zulassung des Therapieverfahrens bei der Dystonie geführt. Die Therapie ist gut etabliert, dennoch hat man gerade bei der Dystonie die Grundlagen der Krankheitsentwicklung noch weniger verstanden als bei Parkinson. Das liegt nicht zuletzt daran, dass Dystonie eine viel seltenere Erkrankung ist.
Prof. Volkmann: Grundsätzlich gehen wir davon aus, dass viele Symptome von Gehirnerkrankungen durch Störungen der Nervenzellnetzwerke entstehen. Gehirnerkrankungen schließen natürlich auch psychiatrische Erkrankungen und psychische Verhaltensauffälligkeiten mit ein. Nun kann man Bewegungsstörungen sehr gut erkennen, klassifizieren und dann bestimmten Netzwerkstörungen zuordnen. Das Problem ist, dass diese Klassifikation bei psychiatrischen Erkrankungen sehr viel schwieriger ist. Es geht um Erkrankungen wie Depression oder Sucht. Die Fragen, die im Moment die Forschung beschäftigen, sind: Gibt es überhaupt so etwas wie einen speziellen Sucht-Regelkreis oder einen Depressions-Regelkreis? Handelt es sich womöglich um bestimmte Symptome, die in einem Syndrom zusammenkommen? Sind es nicht eher der Antrieb oder die Freude, die als Regelkreis im Gehirn repräsentiert sind und je nach Ausprägung ganz unterschiedlich behandelt werden müssten? Und dass das im Tierversuch schwierig abzubilden ist, weil es sehr menschliche Eigenschaften und Verhaltensweisen sind, das können Sie sich sicherlich vorstellen.






