Ob gegen Lebensmittel, Pollen oder Hausstaub – weltweit leiden immer mehr Menschen an Allergien. Die Ausprägung kann stark variieren: Einige erkranken an einer nur schwachen Ausprägung dieser Überreaktion des Immunsystems – für andere sind Allergien mit erheblichen Einschränkungen in ihrem Alltag verbunden. Bisher können in erster Linie die Symptome gut behandelt werden. An Therapien, die das eigentliche Problem an der Wurzel packen, mangelt es noch. Dr. Philipp Yu arbeitet am Institut für Immunologie der Universität Marburg und hat sich auf die Erforschung von Allergien spezialisiert. Dafür führt er auch Untersuchungen an Mäusen durch. Im Interview spricht er über die Bedeutung tierexperimenteller Forschung für sein Arbeitsfeld – aus Sicht des Wissenschaftlers und auch des Patienten.
Sie erforschen die Entstehung von Allergien. Was hat Sie dazu bewogen, sich auf dieses Forschungsfeld zu spezialisieren?
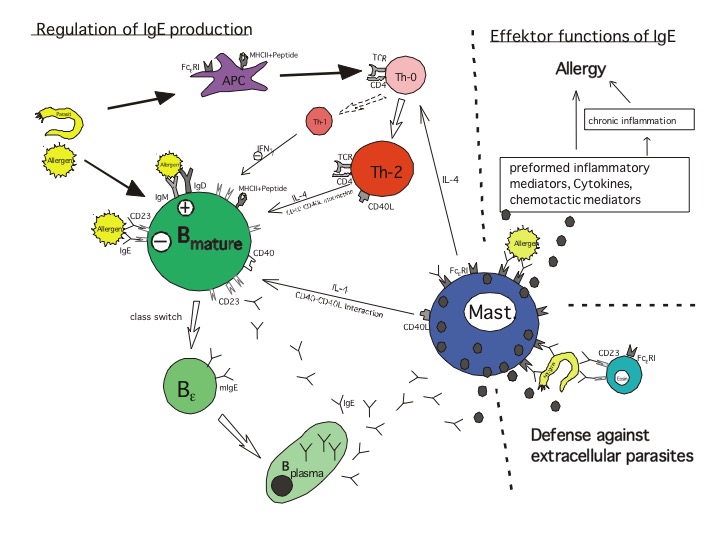
Philipp Yu: Ich möchte mehr darüber erfahren wie Gene, Proteine, Zellen und Organe zusammenwirken, um unseren Körper zu schützen. Mich interessieren besonders B-Zellen. Das sind die Zellen des Immunsystems, die Antikörper produzieren. Während die meisten Antikörper vor Virus- oder Bakterieninfektionen schützen, verbindet man die Klasse der IgE-Antikörper seit ihrer Entdeckung primär nicht mit Schutz, sondern mit Krankheit. Bei den meisten Allergikern findet man stark erhöhtes IgE. Es richtet sich gegen Stoffe wie Hausstaubmilben, Gräserpollen oder Katzenhaare, die eigentlich harmlos sind, weil sie keine Infektionen auslösen. Ich will besser verstehen, wie es überhaupt dazu kommt, dass das Immunsystem IgE-Antikörper produziert, die krank machen.
Der andere Grund, warum ich an IgE und somit an den Grundlagen von Allergien forsche, ist, dass ich seit meiner frühen Kindheit an Neurodermitis und Asthma leide. Ich weiß, wie sich unerträglicher Juckreiz oder lang anhaltende Atemnot anfühlen, und was Panik bedeutet, wenn man sein Notfall-Spray nicht findet.
Allergien nehmen zu, der Bedarf an Therapien steigt. Woran liegt das?
Yu: Eine einfache Antwort darauf gibt es nicht. Zwei zentrale Probleme machen das Verständnis von Allergien so schwierig:
- Allergie ist genetisch gesehen eine komplexe Erkrankung. Nicht ein einzelnes Gen oder eine genetische Variation oder Mutation ist für eine Allergie verantwortlich, sondern das Zusammenspiel von mehreren Genen.
- Wahrscheinlich spielen auch einige Faktoren unseres westlichen Lebensstils – mit weniger Infektionen, guter Hygiene und Nahrung – eine wichtige Rolle bei Allergien. Am bekanntesten ist die Hygiene-Hypothese, laut der unser westlicher Lebensstil zu einer reduzierten Exposition mit Mikroben führt. Das „unterbeschäftigte“ Immunsystem tendiert dadurch eher zu allergischen Reaktionen.
Erkrankungen, die von einer Deregulation von vielen verschiedenen Genen abhängen und stark durch äußere Faktoren beeinflusst werden, sind so kompliziert, dass wir sie im Augenblick weder vollständig verstehen, noch im Labor adäquat nachbilden können.
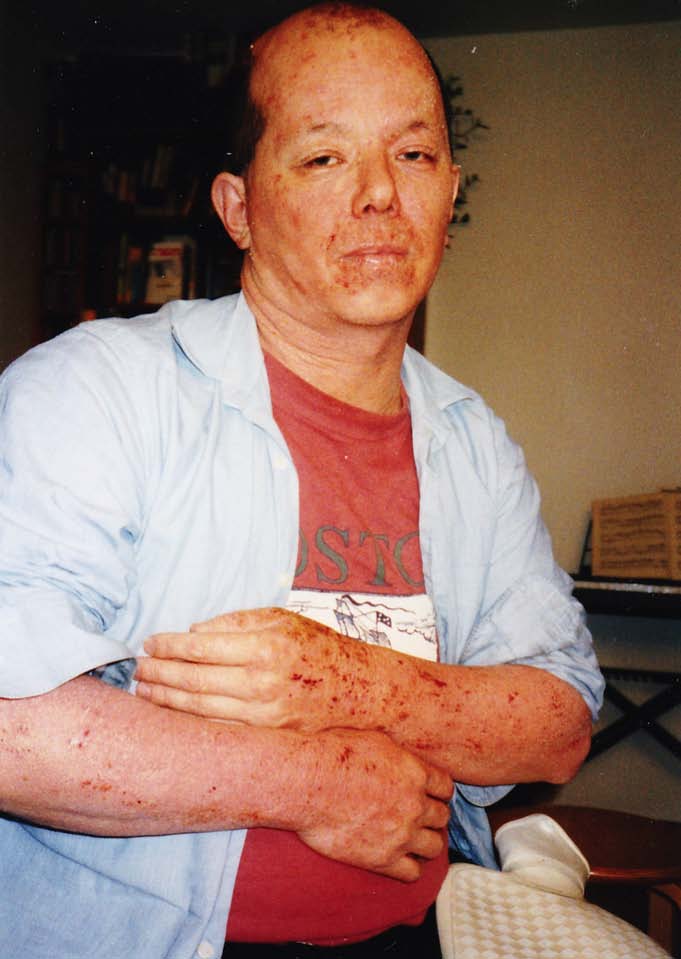
Foto: privat
Welche Behandlungsmöglichkeiten haben Allergiker heute? Und woran fehlt es noch?
Yu: Für Allergiker ist die Vermeidung der Allergene die wichtigste „Behandlungsmöglichkeit“. Wenn kein Allergen (= Antigen) vorhanden ist, gibt es auch keine allergische Immunantwort. Bei einer Katzenhaarallergie ist das relativ leicht, bei einer Hausstaubmilbenallergie schon schwerer, bei einer Pollenallergie (wie z. B. „Heuschnupfen“) nahezu unmöglich.
Leider hat das Immunsystem eine wichtige, aber bei Allergien kontraproduktive Eigenschaft: B-Zellen können eine Gedächtnisform annehmen, sodass auch nach Jahren oder Jahrzehnten noch IgE-Antikörper gegen Allergene im Blut vorhanden sein können. Diese können wieder zu Symptomen führen, wenn man erneut in Kontakt mit dem auslösenden Stoff kommt.
Das Problem vieler Behandlungen ist, dass sie nur die Symptome bekämpfen. Die eigentliche immunologische (De-)Regulation ist bereits abgelaufen, sodass diese Art der Therapie keine Heilung bringt, im besten Fall aber ein einigermaßen normales Leben ermöglicht. Eine Ausnahme stellt die Hypodesensibilisierung dar. Dabei wird dem Allergiker das Allergen in aufsteigenden Dosen zugeführt. Bei einem gewissen Prozentsatz an Patienten kann man so die Art der Antikörper und damit die Symptome positiv beeinflussen. Leider ist die Therapie langwierig und nicht bei allen Patienten erfolgreich. Wir verstehen heute noch zu wenig vom Immunsystem, um diese Therapie gezielt verbessern zu können. Für schwere Allergiker, die resistent gegen solche klassischen Therapien sind, werden seit einigen Jahren Therapien angewandt, die auf künstlich hergestellten Antikörpern beruhen. Auch wenn diese Therapeutika nicht perfekt sind, zeigen sie, dass moderne Forschung in erfolgreiche Therapien mündet.
Welche Allergien untersuchen Sie?
Yu: Ich untersuche die grundsätzlichen molekularen und immunologischen Mechanismen, welche die Produktion von IgE-Antikörpern steuern. B-Zellen werden schon seit circa 50 Jahren intensiv erforscht. Durchbrüche in der Forschung mit B-Zellen haben zum Beispiel zur Anwendung von Antiköpern in der Tumortherapie geführt. Dennoch ist es überraschend, was wir alles noch nicht verstehen. So ist unklar, warum Allergiker auf bestimmte Allergene eine spezifische IgE-Antwort geben, aber auf andere Antigene nicht. Wir versuchen durch unsere Forschung die Grundlagen für die Entwicklung besserer Medikamente zu schaffen.
Mit welchen Methoden gelangen Sie zu Ihren Ergebnissen?
Yu: Für biochemische und genetische Experimente verwende ich menschliche Zellen und Mäusezellen. Um die daraus gewonnenen Ergebnisse zu verifizieren, muss ich die Rolle von IgE aber auch „in vivo“, d. h. im lebenden Organismus, untersuchen. Dafür verwende ich genetisch veränderte Mäuse, z. B. Tiere, denen der Rezeptor für IgE auf B-Zellen fehlt oder die verstärkt IgE produzieren.
Tierexperimentelle Forschung steht immer wieder in der Kritik, weil nicht selten Jahrzehnte vom Tierversuch bis zur Zulassung eines Medikaments oder einer Therapie vergehen. Geht es nicht schneller?
Yu: Diese Kritik ist verständlich, aber nicht berechtigt, denn sie gibt den Tierversuchen die Schuld. Das eigentliche Problem, das die Medikamentenentwicklung so schwierig und langwierig macht, ist die Komplexität der Erkrankung. Tierversuche sind ein integraler Bestandteil biomedizinischer Forschung, wenn wir diese komplizierten Zusammenhänge besser verstehen wollen.
Fünf Jahre, um eine gute Hypothese zu finden, zu testen und zu publizieren ist eine lange Zeit. Man kann weitere zehn bis 15 Jahre rechnen, bis ein Medikament entwickelt und zugelassen wird. Hier muss man auch erwähnen, dass auf diesem langen Weg die große Mehrheit der Medikamenten-Kandidaten durchfällt. Meiner Meinung nach könnte aber eine engere Zusammenarbeit zwischen pharmazeutischen Firmen, klinischer Forschung und Grundlagenforschung zu besseren und schnelleren Ergebnissen führen.
Können Sie in ihrem Forschungsfeld auf Alternativen zum Tierversuch zurückgreifen?
Yu: Man sollte in dieser Frage nicht den Fehler begehen, ein „entweder oder“ zwischen Tierversuch und anderen Methoden im Labor zu konstruieren! Beides ist wichtig. Um IgE und damit Allergie zu verstehen, nutze ich Zelllinien von Maus und Mensch. Wir inaktivieren Gene durch CRISPR/Cas9 oder fügen Gene hinzu, sodass wir die Biochemie und Interaktion von IgE verstehen lernen. Würden wir hier aber stehen bleiben, könnten die Ergebnisse nie guten Gewissens am Menschen angewandt werden. Die IgE produzierende B-Zelle ist beispielsweise keine statische Zelle, sondern interagiert mit anderen Zellen, um zu reifen, vom Knochenmark über die Milz bis zum Lymphknoten. Dann gibt es noch den Effekt, dass B-Zellen im Laufe einer Immunantwort Antikörper produzieren, die stärker an ihr Ziel binden (Reifung), und dass sie zu Gedächtniszellen werden (Memory). Dies alles geschieht nur im Menschen und im lebenden Tier und nicht in einer isolierten Zelle in einer Petrischale.
Zellkulturen, künstliche Organe oder Computermodelle als vollständiger Ersatz für Tierversuche sind schlicht nicht möglich. Selbst um Alternativen zu Tierversuchen zu finden, muss man zuerst verstehen, wie Mensch und Maus funktionieren. Die genannten Methoden, die sich noch in der Entwicklung befinden, heute schon als realistischen Ersatz für Tierversuche darzustellen, ist meiner Meinung nach unredlich.
Was wären die Folgen eines von Tierschützern geforderten Verbots aus Sicht des Wissenschaftlers und des Patienten?
Yu: Eine weitere Einschränkung oder gar ein Verbot von Tierversuchen würde die Grundlagenforschung in Deutschland und ganz Europa schädigen. Als Wissenschaftler würde mir ein zentraler Baustein fehlen, Mechanismen der Immunregulation in einem Säugetier verstehen zu lernen. Die Entwicklung von B-Zellen und die IgE-Regulation bei Infektionen können nicht im Menschen untersucht werden, da man aus guten Gründen Menschen nicht genetisch verändern, mit Pathogenen infizieren oder ihnen Milzzellen entnehmen kann. Abgesehen von einem kompletten Verlust der Wettbewerbsfähigkeit meiner Forschung, muss man davon ausgehen, dass die Experimente in anderen Ländern durchgeführt werden würden.

Foto: privat
Natürlich würde ich mir schnelle, einfache Lösungen wünschen, aber das Argument, dass trotz jahrzehntelangen Tierexperimenten immer noch die meisten Krankheiten nicht heilbar sind, zeigt eigentlich nur, wie gering das Verständnis der Kritiker dafür ist, welcher schwierigen Materie wir gegenüberstehen. Für komplexe Probleme gibt es keine einfachen Lösungen. Dies ist eine Wahrheit, die man dem Patient klar sagen muss. Denn als Wissenschaftler lernt man schnell, dass es in der Tat viel Geld und harte Arbeit braucht für langwierige Forschung, die dann möglicherweise längerfristig zu besseren Medikamenten oder einer Heilung von chronischen Erkrankungen führen kann.
Ich werde oft gefragt, was die moralische Rechtfertigung meiner Arbeit im Labor mit Versuchsmäusen ist. Die Versuchstiere dienen dem Zweck, unser Wissen zu erweitern und darauf basierend bessere Medikamente zu entwickeln. Als Patient mit einer unheilbaren chronischen Erkrankung reicht mir dies als Begründung aus. Ich habe Respekt vor Menschen, die Medikamente gegen schwerste Erkrankungen nicht nehmen würden, weil für Forschung Versuchstiere getötet wurden. Was ich nicht nachvollziehen kann, ist, wenn man anderen Menschen, oder einer ganzen Gesellschaft, seine Einschätzung vorschreibt und den „Wert“ bzw. das Leiden einer Versuchsmaus mit dem eines Menschen gleichsetzt.
Meine Meinung ist, dass durch die Einschränkung oder ein Verbot von Tierversuchen in der Forschung, kranken Menschen die einzige Hoffnung auf Heilung genommen werden würde.






