Im Laufe der langjährigen Medikamenten-Entwicklung wird der Wirkstoff in klinischen Studien erstmals auch im Menschen eingesetzt. Wie funktionieren klinische Studien eigentlich – und wie sicher sind sie? Kai Schmidt-Ott, Professor und Forschungsgruppenleiter am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft, spricht über die Notwendigkeit und Bedeutung von Medikamententests an Menschen und wie sicher sie einzustufen sind.
Herr Schmidt-Ott, jedes Medikament muss an einem bestimmten Punkt seiner Entwicklung zum ersten Mal von Menschen getestet werden. Wer erklärt sich dafür bereit und warum?
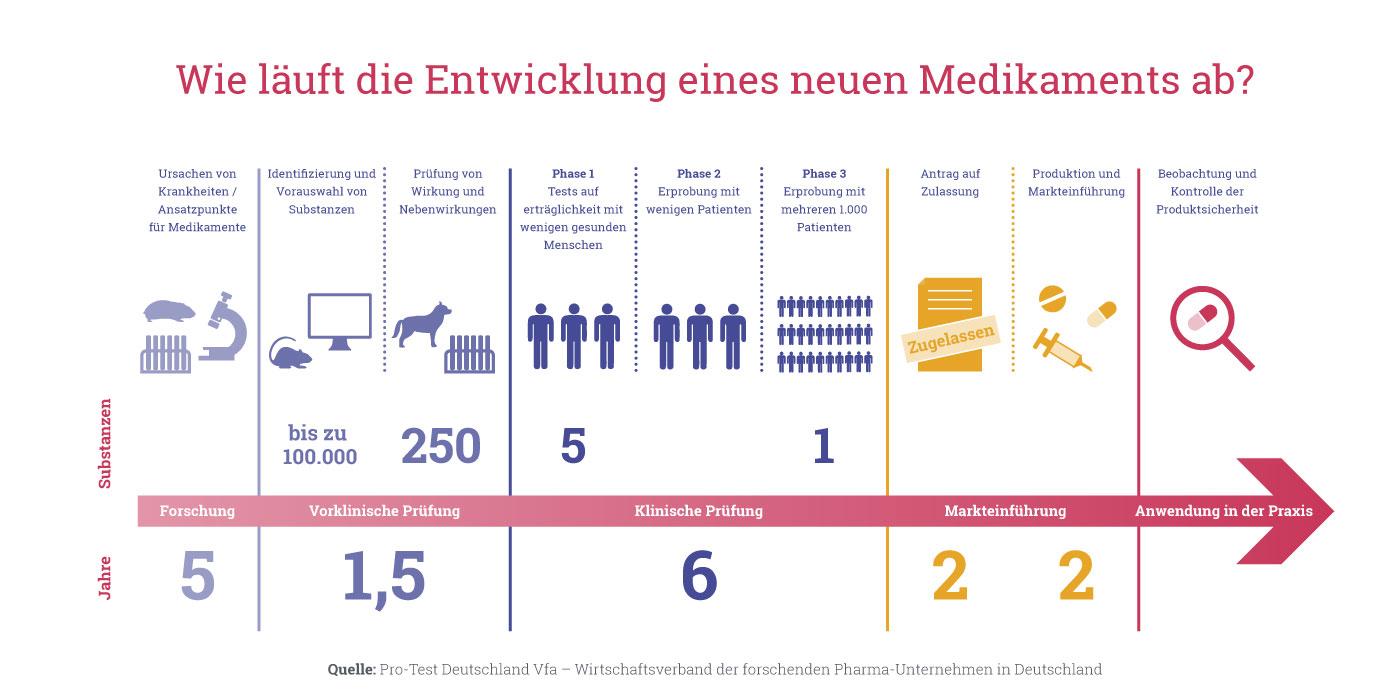
Kai Schmidt-Ott: Zunächst einmal ist es so, dass dem ersten Medikamenteneinsatz am Menschen eine langjährige Entwicklungszeit vorausgeht. Dabei wird einerseits umfassend geprüft, ob das potenzielle Medikament gegenüber vergleichbaren, schon zugelassenen Arzneimitteln in dem zu behandelnden Krankheitsfeld tatsächlich besser geeignet ist. Andererseits wird der Wirkstoff erst dann im Menschen eingesetzt, wenn bestmöglich geprüft wurde, ob er tatsächlich sicher ist. Erst wenn beides der Fall ist und dies von einer Ethikkommission und der zuständigen Aufsichtsbehörde – in Deutschland ist das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) oder das Paul- Ehrlich-Institut (PEI) – geprüft wurde, beginnen die sogenannten klinischen Studien. Hier wird das Medikament am Menschen getestet. Diese Studien umfassen vier Phasen. In der Regel sind die Probanden in der Phase 1 gesunde Freiwillige. Sie machen es oft ganz einfach deshalb, weil es dafür eine finanzielle Entschädigung gibt.
Warum nimmt man gesunde Freiwillige, und nicht gleich Patienten, die mit dem Medikament später behandelt werden sollen?
Schmidt-Ott: Weil es erst einmal um die Bestätigung geht, dass das Medikament für den Menschen grundsätzlich sicher ist. Würde sofort an kranken Patienten getestet, wäre es schwierig, unerwünschte Effekte des Medikaments von den ohnehin bestehenden Krankheitssymptomen zu trennen. Außerdem haben gesunde Menschen eine gute Leber- und Nierenfunktion, was wichtig für den Abbau und die Ausscheidung des Medikaments ist. Selbst wenn unerwartete Wirkungen auftreten, könnten gesunde Menschen dies besser kompensieren.
Sie sagen, es wird möglichst alles dafür getan, dass das Medikament nicht zur Gefahr für die Gesundheit wird und dass es nicht zu unerwarteten Wirkungen kommt. Wie wird das gewährleistet?
Schmidt-Ott: Der menschliche Stoffwechsel ist inzwischen ziemlich gut erforscht. Beispielsweise lassen sich anhand von Computermodellen die Wirkung und der Verbleib von Arzneimittelkandidaten im Körper schon sehr gut berechnen. Wichtiger und entscheidender sind jedoch die Tierversuche: Bevor ein Medikament in die klinische Entwicklung kommt, wird es immer erst am Tier getestet. Anhand von Studien, die die Giftigkeit und das Verhalten des Medikaments im Tiermodell untersuchen, lässt sich abschätzen, wie das Medikament womöglich im Menschen wirkt. Gibt es hier keinerlei Bedenken, beginnt die klinische Phase-1-Studie als zusätzliche Vorsichtsmaßnahme mit der Gabe einer besonders geringen Dosis.
Wie oft kommt es zu Zwischenfällen?
Schmidt-Ott: In Deutschland ist meinem Wissen nach noch nie ein Patient in einer Phase-1-Studie nach Einnahme eines Wirkstoffes gestorben. Im Fachmagazin British Medical Journal gab es eine Metaanalyse von Phase-1-Studien mit über 10.000 Patienten. Auch hier gab es keine Todesfälle. Der tote Proband in Frankreich Anfang 2016 ist die absolute Ausnahme. Unerwünschte Wirkungen können dennoch gelegentlich auftreten. In 0,3 Prozent der Fälle kann es auch zu schweren Komplikationen kommen. Das heißt unterm Strich: Das Ganze ist ziemlich sicher, aber es gibt eben immer auch ein Restrisiko.
Es gibt auch ein paar wenige Medikamente, die starke Nebenwirkungen haben, etwa Chemotherapeutika für die Krebstherapie. Werden diese auch an gesunden Freiwilligen getestet?
Schmidt-Ott: Wenn sich erhebliche Nebenwirkungen medizinisch gut einschätzen lassen und das Medikament einen deutlichen Nutzen verspricht, kommt es vor, dass die Phase mit den gesunden Probanden übersprungen wird: Man verabreicht das potenzielle Medikament direkt denjenigen, die damit später einmal behandelt werden sollen.
Und was ist, wenn ein Medikament rasch gebraucht wird, etwa eines gegen Ebola während einer Pandemie oder gegen das Zika-Virus? Dauert das Testen an gesunden Probanden nicht zu lange?
Schmidt-Ott: Auch hier gelten prinzipiell die gleichen Grundregeln. Allerdings bieten die zuständigen Behörden beschleunigte Zulassungsverfahren an, die es in Ausnahmefällen erlauben, neue Medikamente für schwerwiegende oder besonders seltene Erkrankungen den Patienten schneller zur Verfügung zu stellen. Dadurch wird zum Beispiel eine vorläufige Zulassung bereits vor dem Abschluss der vollständigen klinischen Prüfung möglich.
Sie sprachen von vier klinischen Phasen. Wie geht es nach der ersten klinischen Phase bei der Medikamentenentwicklung weiter?
Schmidt-Ott: In Phase-2-Studien prüfen die Ärzte anhand von mehreren Hundert Patienten, ob das Medikament prinzipiell wie gewünscht wirkt. In den Phase-3-Studien geht es darum, das Überwiegen der Vorteile des Medikaments an mehreren Tausend Patienten zu zeigen. Wenn alle Phasen erfolgreich waren, kann das Medikament zugelassen werden. Aber auch wenn es dann auf dem Markt ist, beobachten es Ärzte in Phase-4-Studien für eine gewisse Zeit weiter. Hier geht es vor allem darum aufzuzeigen, ob ein Medikament extrem seltene Nebenwirkungen hat, die gegebenenfalls erst später auftreten und bisher noch nicht entdeckt wurden.
15.08.2016, Interview: Christian Heinrich
zuerst erschienen auf www.helmholtz.de